Лабораторная работа
1. Определение буферных свойств биологических жидкостей Опыт 1 В четыре одинаковые пробирки с помощью пипетки отмерить по 1 мл сыворотки крови. Первую пробирку оставить для контроля, во вторую добавить 5 кап. 0,025 N раствора NаОН, в третью - 0,025 N раствора НСl, в четвёртую – 5 кап. воды. Затем во все пробирки добавить по 1-2 капли универсального индикатора и по цветной шкале универсального индикатора определите приблизительное значение рН. Опыт 2. В четыре одинаковые пробирки с помощью пипетки отмерить по 1 мл ацетатного буфера. Первую пробирку оставить для контроля, во вторую добавить 5 кап. 0,025 N раствора NаОН, в третью - 0,025 N раствора НСl, в четвёртую – 5 кап. воды. Затем во все пробирки добавить по 1-2 капли универсального индикатора и по цветной шкале универсальног индикатора определите приблизительное значение рН. Опыт 3. В две одинаковые пробирки с помощью пипетки отмерить: в первую – 5 кап. воды, во вторую 5 кап. слюны. Добавить в каждую пробирку по 1-2 капли универсального индикатора и определить примерное значение рН. Затем добавить в обе пробирки по 1 капли 0,01 N раствора НСl. Что наблюдаете? Охарактеризуйте буферные свойства слюны. Результаты опытов занесите в таблицу № 1. Таблица № 1.
2. Зависимость рН буферных растворов от соотношения компонентов Опыт 1. В три пробирки с помощью пипетки отмерить 0,2 N Nа2НРО4 и 0,2 N NаН2РО4 в количествах, указанных в таблице № 2. добавьте в каждую пробирку по две капли универсального индикатора и определите рН по цветной шкале универсального индикатора. Таблица № 2.
Вычислите рН исследуемых растворов по формуле Гендерсона – Гассельбаха: рН = рК + ℓg Сделайте вывод зависимости рН от соотношения концентраций компонентов буферной смеси.
Упражнения: 1. Константа диссоциации NH4OH равна 1,8 · 10-5. Можно ли приготовить аммиачный буфер с рОН = 4,7 2. Можно ли приготовить ацетатный буфер с рН = 5,4, если Кд (СН3СООН) = 1,6 · 10 -7? 3. Рассчитайте рОН буфера, состоящего из 50 мл 0,1 н р-ра СН3СООН и 100 мл 0,01 н р-ра СН3СООNa, если рК = 4,7. 4. Рассчитайте рН буфера, состоящего из 40 мл 0,2 н р-ра NH4ОН и 80 мл 0,01 н р-ра NH4CI, если рК = 4,4. 5. Для приготовления буфера взяты 50 мл 2 н р-ра NH4ОН и 100 мл 0,1 н р-ра NH4С1 (рК = 4,4). Как изменится рОН этого раствора, если к нему добавить: а) 10 мл р-ра 0, 1 н НС1, б) 200 мл воды? 6. Для приготовления ацетатного буфера взяты 100 мл 0,01 н р-ра СН3СООН и 50 мл 0,01 н р-ра СН3СООNa, (рК = 4,7). Как изменится рОН этого раствора, если к нему добавить: а) 25 мл 0,1н р-ра NaОН, б) 25 мл воды? 7. Рассчитайте буферную ёмкость буфера, состоящего из 0,05 моль/экв соли и 0,1 моль/экв кислоты, если к 1 л этого буфера добавить 20 мл 0,5 N р-ра НС1 (рК к-ты = 4,7). 8. Какова буферная ёмкость фосфатного буфера, если при добавлении 3 мл 0,1 н р-ра НСI К 20 мл этого буфера рН меняется от 7,4 до 7,1?
|

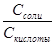 , Кд (Н2РО4-) = 1,5 · 10-7
, Кд (Н2РО4-) = 1,5 · 10-7


