Основные параметры молекул
Информацию о строении вещества можно получить, исследуя его физические и химические свойства. С помощью физических методов определяют основные параметры молекул: межъядерные расстояния (т.е. расстояния между центрами атомов) и углы между связями (валентные углы). Межъядерное расстояние между химически связаннами атомами называется длиной связи. Например, в молекуле воды длина связи О-Н (расстояние между ядрами водорода и кислорода) равна 0,96 Важнейшей характеристикой химической связи является энергия связи Е, определяющая ее прочность. Мерой прочности связи может служить количество энергии, затрачиваемое на ее разрыв. Например, средняя энергия связи О-Н в молекуле Н2О составляет 498 кДж/моль. Длина и энергия связи, валентные углы, а также экспериментально определяемые магнитные, оптические, электрические и другие свойства веществ непосредственно зависят от характера распределения электронной плотности в молекулах. Окончательное заключение о строении вещества делают после сопоставления информации, полученной разными методами. 2.9. Метод молекулярных орбиталей
Рассмотренный метод ВС обладает многими достоинствами. Он относительно прост и нагляден и позволяет предсказать свойства многих молекул, таких как пространственная конфигурация, полярность, энергия и длина связи и др. Однако свойства некоторых молекул и ионов метод ВС объяснить не в состоянии. Более общим является метод молекулярных орбиталей (МО), который позволяет объяснить ряд явлений, не понятных с точки зрения метода ВС (парамагнетизм молекул кислорода; бóльшую прочность связей в молекулярных ионах F2+ и O2+, чем соответственно в молекулах F2 и O2 и др.). В основе метода молекулярных орбиталей лежит представление об общих молекулярных орбиталях. Электроны в атоме принадлежат не каждому атому в отдельности, а всей молекуле в целом, образуя молекулярные орбитали. Если в методе ВС атомы молекул сохраняют определенную индивидуальность, то в методе МО молекула рассматривается как единая система. Перекрывание атомных орбиталей соответствует математической операции сложения электронных плотностей, при которой возникает молекулярная орбиталь. Операция сложения осуществляется только с атомными орбиталями, имеющими антипараллельные спины. Если спины атомных орбиталей параллельны, то эти электроны отталкиваются, что соответствует операции вычитания электронных плотностей. Так как в молекулах имеются орбитали как с антипараллельными спинами, так и с параллельными, то необходимо при описании электронного состояния учитывать и взаимодействие орбиталей, отвечающее операции вычитания. Указанный метод расчета химической связи называется методом линейной комбинации атомных орбиталей (ЛКАО). Две молекулярные орбитали, которые всегда образуются при комбинировании двух атомных орбиталей, различаются по энергии. При операции суммирования, когда электронная плотность в области между ядрами возрастает и образуется связь, энергия системы понижается. Молекулярная орбиталь, которая возникает при суммировании атомных орбиталей и которая энергетически более выгодна, называется связывающей. По аналогии со связывающими орбиталями вводится представление о разрыхляющих орбиталях, получаемых операцией вычитания. Связывающей МО отвечает повышенная электронная плотность в области связывания (между атомными ядрами), а разрыхляющей МО– повышенная электронная плотность в области разрыхления (по обе стороны за атомными ядрами). Образование связывающих МО снижает энергию молекулы и укрепляет химическую связь, а электроны на разрыхляющих МО ослабляют химическую связь. Вероятность пребывания электронов в связывающих МО высокая, а в разрыхляющих – низкая, поэтому электроны при образовании молекулы вначале занимают связывающие МО, а затем – разрыхляющие МО. Так как каждые две атомные орбитали дают одну связывающую и одну разрыхляющую орбитали, то общее число молекулярных орбиталей равно общему числу атомных. Число электронов на молекулярных орбиталях равно сумме электронов на атомных орбиталях. По аналогии с атомными s -, p-, d -, f –орбиталями молекулярные орбитали обозначаются греческими буквами Молекулярные орбитали, полученные при комбинации s - АО, называются
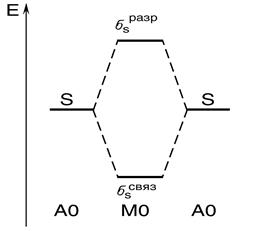
Рис. 27. Образование связывающей и разрыхляющей молекулярных орбиталей из атомных s –орбиталей
Рис. 28. Образование связывающей и разрыхляющей молекулярных орбиталей из атомных рХ –орбиталей Заполнение молекулярных орбиталей электронами подчиняется правилам заполнения атомных орбиталей. - Молекулярные орбитали заполняются в порядке увеличения их энергии. - Заполнение молекулярных уровней начинается с орбитали самого низкого энергетического уровня:
Энергетическое состояние молекулы зависит от числа комбинаций операций суммирования и вычитания, проводимых с атомными орбиталями при формировании молекулярных орбиталей. В соответствии с принципом Паули в молекуле не может быть двух электронов со всеми одинаковыми квантовыми числами (иодновременно находящихся на одной молекулярной орбитали). Заполнение молекулярных орбиталей одного энергетического уровня подчиняется правилу Гунда. Сначала энергетически равноценные молекулярные орбитали заполняются одиночными электронами, а затем происходит их заполнение вторыми электронами. Схему формирования молекулярных орбиталей (рис. 29)
Рис. 29. Энергетическая схема образования МО из атомных s -орбиталей принято изображать в виде энергетической диаграммы молекулярных орбиталей, где по вертикали откладывают значение энергии, причем уровни атомных орбиталей (АО) располагают по обе стороны от уровней молекулярных орбиталей (МО) получающейся молекулы. На рис. 30 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода.
Рис. 30. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода
Следует отметить, что при образовании молекул B2, C2 и N2 энергия связывающей Образование химической связи в молекуле кислорода можно представить электронными конфигурациями:
2 О […2 s2 2 p4 ] → O2
O2 [(
Две атомные 2 s – орбитали дают две молекулярные орбитали:
Рис. 31. Диаграмма энергетических уровней молекулы O2
Перекрывыние атомных рХ – орбиталей приведет к образованию двух молекулярных Две другии орбитали 2 рY и 2 pZ перекрываются боковыми поверхностями с образованием Из восьми 2 р – электронов двух атомов О размещенными оказываются только шесть, которые занимают три связывающие МО (2 рх, 2 рy, 2 pz). По принципу минимума энергии оставшиеся два 2 р -электрона размещаются на двух разрыхляющих МО (2 рy, 2 pz), которые ниже по энергии, чем Наличие двух неспаренных электронов с параллельными спинами на разрыхляющих (несвязывающих) Порядок связи n в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу. Порядок связи в молекуле кислорода равен(6 -2) / 2 = 2. Рассмотренные методы валентных связей и молекулярных орбиталей не исключают, а взаимно дополняют друг друга. Метод ВС позволяет объяснить химические связи и свойства многих соединений. Метод МО обеспечивает общий подход ко всем типам химических соединений и позволяет рассчитать с помощью ЭВМ параметры связей и соединений.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Укажите, у каких из приведенных молекул химические связи имеют полярный характер: F2, CO, N2, HBr, Br2. 2. Объясните донорно-акцепторный механизм образования ковалентной связи на примере иона NH4+. 3. Укажите тип гибридизации и валентный угол в молекулах С2Н2, С2Н4, С2Н6.
|

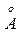 , а угол между связями О-Н, направленными от атома кислорода, равен 104,5о.
, а угол между связями О-Н, направленными от атома кислорода, равен 104,5о. 
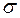 ,
, 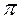 ,
,  ,
,  .
.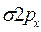 – МО (где х – координата по линии, соединяющей ядра атомов); при комбинации рy – АО и pz – АО –
– МО (где х – координата по линии, соединяющей ядра атомов); при комбинации рy – АО и pz – АО –  - и
- и 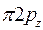 - МО (рис.28).
- МО (рис.28).


 )2(
)2( )2(
)2( )2(
)2(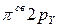 )2(
)2( )2 (
)2 ( )1(
)1( )1.
)1. -,
-, 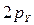 - и
- и  -орбиталей каждого атома кислорода образуются три связывающие и три разрыхляющие молекулярные орбитали (рис. 31).
-орбиталей каждого атома кислорода образуются три связывающие и три разрыхляющие молекулярные орбитали (рис. 31).
 -орбиталей - (связывающей и разрыхляющей) – в соответствии с операциями сложения и вычитания, причем энергетический уровень
-орбиталей - (связывающей и разрыхляющей) – в соответствии с операциями сложения и вычитания, причем энергетический уровень  .
.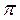 - связей. Операции сложения и вычитания дают две молекулярные орбитали
- связей. Операции сложения и вычитания дают две молекулярные орбитали 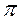 разрy,
разрy, 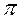 разрz - орбиталях хорошо объясняет парамагнетизм молекулы кислорода; молекулы О2 втягиваются в магнитное поле в отличие от диамагнитных молекул (не имеющих неспаренных электронов) N2 и F2.
разрz - орбиталях хорошо объясняет парамагнетизм молекулы кислорода; молекулы О2 втягиваются в магнитное поле в отличие от диамагнитных молекул (не имеющих неспаренных электронов) N2 и F2.


