МИНИСТЕРСТВО ОБРАЗОВАНИЯ и науки
РОССИЙСКОЙ ФЕДЕРАЦИИ
_______________________________________________________
Казанский государственный
Технологический университет
Расчет
Насадочного декарбонизатора
Методические указания
К выполнению контрольной работы по курсу
Процессы и аппараты химической технологии
Казань 2010
1. Общие положения
Наиболее эффективный способ удаления растворенных газов из воды – десорбция. Этот способ основан на известных законах Генри – Дальтона, характеризующих зависимость между концентрацией в воде растворенного газа и его парциальным давлением. Применение этих законов дает возможность определить концентрацию при том условии, что в паровом пространстве над водой находится лишь рассматриваемый газ и отсутствуют другие газы. Концентрация растворенного в воде газа выражается уравнением:
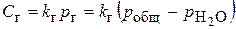 , (1)
, (1)
где 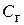 – концентрация растворенного в воде газа;
– концентрация растворенного в воде газа; 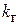 – коэффициент абсорбции газа водой;
– коэффициент абсорбции газа водой;  – общее давление;
– общее давление; 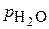 – парциальное давление водяного пара;
– парциальное давление водяного пара; 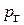 – парциальное давление газа.
– парциальное давление газа.
Как видно из уравнения (1), понижение концентрации газа в воде происходит с уменьшением разности  –
– 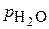 , т.е. в случае приближении парциального давления водяных паров к значению полного давления газовой смеси. Это достигается созданием над поверхностью воды, содержащей рассматриваемый газ, смеси газов, в составе которой практически отсутствует удаляемый из воды газ. Таким образом, для удаления газа из воды необходимо создать условия, при которых парциальное давление его над поверхностью воды было бы равно нулю.
, т.е. в случае приближении парциального давления водяных паров к значению полного давления газовой смеси. Это достигается созданием над поверхностью воды, содержащей рассматриваемый газ, смеси газов, в составе которой практически отсутствует удаляемый из воды газ. Таким образом, для удаления газа из воды необходимо создать условия, при которых парциальное давление его над поверхностью воды было бы равно нулю.
Количество удаляемого газа 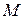 можно определить по уравнению массопередачи
можно определить по уравнению массопередачи
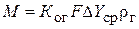 , (2)
, (2)
где 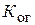 – коэффициент массопередачи,
– коэффициент массопередачи,  – поверхность массопередачи,
– поверхность массопередачи, 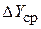 – средняя движущая сила массопередачи,
– средняя движущая сила массопередачи,  – плотность газа.
– плотность газа.
Коэффициент массопередачи 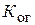 связан с коэффициентами массоотдачи
связан с коэффициентами массоотдачи 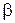 выражением:
выражением:
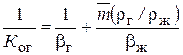 , (3)
, (3)
где 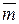 – константа фазового равновесия.
– константа фазового равновесия.
Условно газы подразделяются на хорошо, умеренно и плохо растворимые в жидкостях. Так, в зависимости от константы фазового равновесия m, коэффициентов массоотдачи в жидкой 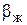 и газовой
и газовой  фазах один и тот же газ может вести себя и как хорошо, и как плохо растворимый. В уравнении (3), член
фазах один и тот же газ может вести себя и как хорошо, и как плохо растворимый. В уравнении (3), член  выражает сопротивление газовой фазе, а
выражает сопротивление газовой фазе, а 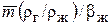 – сопротивление жидкой. В качестве приближенной ориентировки при m <1 газы можно рассматривать как хорошо растворимые, при m > 100, так плохо растворимые, а при m = 1 – 100 – как умеренно растворимые. Примерами хорошо растворимых газов являются NH3 и HCl, плохо растворимым СО2.
– сопротивление жидкой. В качестве приближенной ориентировки при m <1 газы можно рассматривать как хорошо растворимые, при m > 100, так плохо растворимые, а при m = 1 – 100 – как умеренно растворимые. Примерами хорошо растворимых газов являются NH3 и HCl, плохо растворимым СО2.

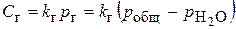 , (1)
, (1)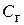 – концентрация растворенного в воде газа;
– концентрация растворенного в воде газа; 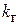 – коэффициент абсорбции газа водой;
– коэффициент абсорбции газа водой;  – общее давление;
– общее давление; 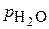 – парциальное давление водяного пара;
– парциальное давление водяного пара; 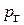 – парциальное давление газа.
– парциальное давление газа.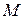 можно определить по уравнению массопередачи
можно определить по уравнению массопередачи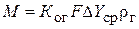 , (2)
, (2)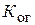 – коэффициент массопередачи,
– коэффициент массопередачи,  – поверхность массопередачи,
– поверхность массопередачи, 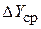 – средняя движущая сила массопередачи,
– средняя движущая сила массопередачи,  – плотность газа.
– плотность газа.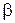 выражением:
выражением: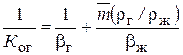 , (3)
, (3)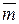 – константа фазового равновесия.
– константа фазового равновесия.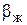 и газовой
и газовой  фазах один и тот же газ может вести себя и как хорошо, и как плохо растворимый. В уравнении (3), член
фазах один и тот же газ может вести себя и как хорошо, и как плохо растворимый. В уравнении (3), член  выражает сопротивление газовой фазе, а
выражает сопротивление газовой фазе, а 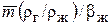 – сопротивление жидкой. В качестве приближенной ориентировки при m <1 газы можно рассматривать как хорошо растворимые, при m > 100, так плохо растворимые, а при m = 1 – 100 – как умеренно растворимые. Примерами хорошо растворимых газов являются NH3 и HCl, плохо растворимым СО2.
– сопротивление жидкой. В качестве приближенной ориентировки при m <1 газы можно рассматривать как хорошо растворимые, при m > 100, так плохо растворимые, а при m = 1 – 100 – как умеренно растворимые. Примерами хорошо растворимых газов являются NH3 и HCl, плохо растворимым СО2.


