Роль железа в организме и использование его соединений в медицине.
По количественному содержанию в организме все d-элементы относятся к микроэлементам. Они входят в состав ферментов, гормонов, витаминов; это значит, что они участвуют в процессах размножения, роста, обмена веществ и т.д. Для медиков большой интерес представляют изменения количества микроэлементов в организме при различных патологических состояниях. Т.е. измерение содержания микроэлементов в органах и тканях позволяет диагностировать и, следовательно, лечить некоторые заболевания.Содержание железа в организме человека 10-5 %. Большая часть железа находится в крови (в эритроцитах в виде вещества гемоглобина), остальное - в ферментах, участвующих в ОВР, в процессах тканевого дыхания и иммуногенеза. Потребность в сутки – 20 мг. Применение: хлорид железа II, влияет на иммуногенез; хлорид железа III – кровоостанавливающее средство; органические препараты железа используют как противоанемические средства. Коррозия – самопроизвольное разрушение металлов и их сплавов под действием окружающей среды. Причины коррозии могут быть разными, но химическая сущность этого процесса одна: атомы металла теряют электроны, при взаимодействии с компонентами окружающей среды (т.е. окисляются), и при этом образуются различные соединения этого металла (оксиды, гидроксиды и т.д.), устойчивые к действию этих компонентов при данных условиях. Коррозия причиняет огромный ущерб. Больше всего страдают от коррозии железо и его сплавы (и как наиболее распространенные в технике и в результате особых свойств железа). Примерно 25% выплавленной за год стали превращается в ржавчину за это время. Особенно активно идет коррозия в аппаратах химической промышленности, здесь на них действуют различные агрессивные вещества (окислители, кислоты, щелочи…), к тому же при повышенном давлении и температуре. Но убытки от коррозии — это не только потеря металла, это выход из строя оборудования и сооружений, загрязнение окружающей среды, аварии и гибель людей. При повышенной температуре металлы окисляются кислородом воздуха или другими неметаллами (хлором и т.д.), например: Fe + O2 → Fe2O3 Такая коррозия называется газовой. Часто коррозия развивается во влажном воздухе и тогда на поверхности металла образуется тончайшая пленка влаги, в которой растворены кислотные оксиды (прежде всего СО2). Иногда металл контактирует с растворами электролитов (грунтовая вода, морская вода, почва…). В этих случаях окислителями выступают ионы водорода или реакция протекает с участием молекул воды. Такая коррозия называется электрохимической. Например: Fe + H2O + O2 → Fe(OH)2 Fe(OH)2 + H2O + O2 → Fe(OH)3 Fe + H2CO3 → FeCO3 + H2 Для защиты металлов от коррозии применяют различные методы. 1. Покрытия. Чтобы прекратить контакт металла с окружающей средой используют различные покрытия. Они бывают: А) металлические покрытия (никелирование, хромирование, оцинкование, лужение и т.д.). Для этого используют: 1) малоактивный металл, который не подвергается быстрой коррозии (Sn); 2) металл, образующий прочную оксидную пленку, защищающую от дальнейшей коррозии (Al); 3) активный металл, «принимающий удар на себя» (Zn). Б) неметаллические покрытия: лаки, краски, эмали, полимеры. 2. Ингибиторы коррозии. В растворы, которые контактируют с металлами, добавляют вещества, обладающие отрицательной каталитической активностью, т.е. уменьшающие скорость химических реакции коррозии. Например, для систем отопления используют метафосфаты натрия. 3. Катодная защита. Если станину станка или металлоконструкцию подсоединить к отрицательному полюсу постоянного источника тока, то процессы окисления металла проходить не будут. 4. Протекторы. Если к корпусу судна подсоединить кусок активного металла (Zn), то окисляться будет он, а не стальной корпус. 5. Коррозионностойкие сплавы. Добавление некоторых металлов (Cr, Ni) в сплавы железа делают их устойчивыми к коррозии. Сплавы. Для большинства металлов характерна способность растворятся друг с другом в расплавленном состоянии и при охлаждении образовывать сплавы. Сплавы могут состоять из двух и более компонентов. Это могут быть металлы, неметаллы и продукты их взаимодействия. Сплавы используют очень широко, потому что чистые металлы не всегда обладают всем набором качеств, которые необходимы для той или иной цели. Сплавы сочетают свойства металлов, которые вошли в состав сплава, а иногда даже появляются свойства, которых не имели исходные вещества. Сплавы бывают двух видов: 1) Если сплавляют близкие по свойствам металлы, то они смешиваются неограниченно друг с другом и образуют твердые растворы (дюралюминий: Al и Cu). Такие сплавы прочные, пластичные, сочетают свойства компонентов, но новых свойств от них ждать не приходится. 2) Если компоненты очень различны по природе, то каждый кристаллизуется отдельно, и сплав – механическая смесь мельчайших кристаллов этих компонентов (чугун: Fe и С). Такие сплавы хрупкие, на разломе можно различить кристаллы разных компонентов, возможно появление новых свойств (например, чугун расширяется при охлаждении).
|

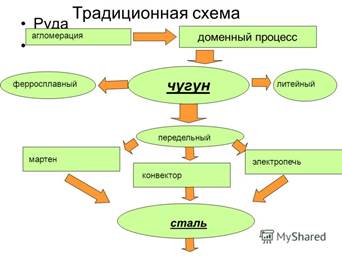 3) Если компоненты взаимодействуют между собой, то образуются т.н. соединения интерметаллиды, обладающие какими-то свойствами, отличными от свойств исходных веществ (чугун: Fe3С- цементит, обуславливает высокую твердость чугуна).
3) Если компоненты взаимодействуют между собой, то образуются т.н. соединения интерметаллиды, обладающие какими-то свойствами, отличными от свойств исходных веществ (чугун: Fe3С- цементит, обуславливает высокую твердость чугуна).


