Получение
Процесс удаления лишнего углерода из чугуна называют переделкой. Его суть заключается в окислении «лишнего» углерода кислородом. Этот процесс проводят в мартеновских печах или кислородных конвекторах. Сырьем кроме чугуна является железный лом, легирующие добавки, кислород. В результате получается ковкий сплав железа – сталь.
Соединения железа. Для всех переходных металлов характерна зависимость свойств соединений от степени окисления. Чем выше с.о. элемента тем сильнее проявляются кислотные и окислительные свойства его соединения. Железо (II) FeO (твердое черное вещество, нерастворимое в воде) Fe(OH)2 (бледно-зеленый студенистый осадок, твердое вещество практически нерастворимое в воде) FeCl2 и др. (кристаллические вещества бледно-зеленого цвета, используют в с/х как микроудобрение) Основные свойства оксида и гидроксида (т.е. они вступают в реакцию нейтрализации с кислотами) FeО + HCl → FeCl2 + H2О Fe(OH)2 + H2SO4 → FeSO4 + H2O Восстановительные свойства (т.е. они легко окисляются) Fe(OH)2 + O2 + H2O → Fe(OH)3 Железо (III) Fe2O3 (твердое вещество красно коричневого цвета, нерастворимое в воде, известно под названием железный сурик, используется как пигмент для красок, как окислитель в пиротехнических смесях) Fe(OH)3 (бурый студенистый осадок, твердое вещество практически нерастворимое в воде, ржавчина) FeCl3 и др. (кристаллические вещества коричневого или желтого цвета, используют для очистки воды, в медицине - как окислитель, бактерицидное средство) Амфотерные свойства (т.е. они вступают в реакцию нейтрализации и с кислотами и со щелочами) Fe(OH)3 + HCl → FeCl3 + H2О Fe(OH)3 + NaOH → Na3[Fe(OH)6] Окислительные свойства (проявляются слабо, т.е. взаимодействуют с сильными восстановителями) FeCl2 + H2S → FeCl2 + S + HCl
|

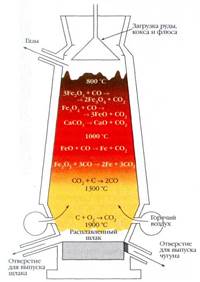
 1. Восстановлением из оксидов (доменный процесс) Суть процесса: Fe2O3 + С → Fe + СO2, т.е. восстановление оксида железа, содержащегося в железной руде, коксом. Третьим компонентом необходимым для доменного процесса являются флюсы (СаСО3), они переводят тугоплавкие пустые породы (SiO2) в легкоплавкие и легкие шлаки (силикаты). Процесс проводят в домнах (печи высотой обычн о около 25 м и диаметром до 10 м). Это непрерывный производственный процесс. Сверху засыпают шихту (кокс, руда, флюсы), снизу подают кислород. Восстановленное железо плавится и стекает в нижнюю часть печи – горн. Оттуда его периодически выпускают. Но это железо содержит много углерода. Т.е. в домнах получают не железо, а его сплав – чугун.
1. Восстановлением из оксидов (доменный процесс) Суть процесса: Fe2O3 + С → Fe + СO2, т.е. восстановление оксида железа, содержащегося в железной руде, коксом. Третьим компонентом необходимым для доменного процесса являются флюсы (СаСО3), они переводят тугоплавкие пустые породы (SiO2) в легкоплавкие и легкие шлаки (силикаты). Процесс проводят в домнах (печи высотой обычн о около 25 м и диаметром до 10 м). Это непрерывный производственный процесс. Сверху засыпают шихту (кокс, руда, флюсы), снизу подают кислород. Восстановленное железо плавится и стекает в нижнюю часть печи – горн. Оттуда его периодически выпускают. Но это железо содержит много углерода. Т.е. в домнах получают не железо, а его сплав – чугун. 2. Алюминотермия используется в странах имеющих дешевую электроэнергию.
2. Алюминотермия используется в странах имеющих дешевую электроэнергию.


