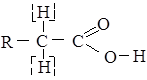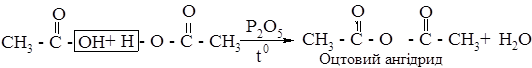Хімічні властивості
Для насичених монокарбонових кислот характерна висока реакційна здатність. Це визначається, головним чином, реакціями карбоксильної групи (розрив зв’язків О – Н і С – О), а також реакціями заміщення атомів „Н” біля α−вуглецевого атому:
1. Реакції з розривом зв’язку О – Н (кислотні властивості, обумовлені рухливістю атома водню карбоксильної групи. Насичені монокарбонові кислоти мають всі властивості звичайних кислот. 1. Дисоціація. У водних розчинах монокарбонові кислоти ведуть себе як одноосновні кислоти - дисоціюють, утворюючи йон водню і карбоксилат аніон: R-COOH ↔ RCOO- + H+ Карбоксилат аніон побудований симетрично, негативний заряд делокалізований між атомами к оксигену карбоксильної групи. Делокалізація стабілізує карбоксилат –іон.
Карбонові кислоти є слабкими кислотами. Найсильнішою в гомологічному ряду є мурашина кислота, в якій група СООН зв’язана з атомом водню. Алкільні радикали в молекулах слідуючих членів гомологічного ряду мають позитивні індуктивні ефекти (+І) і зменшують позитивний заряд на атомі вуглецю карбоксильної групи. Це в свою чергу ослаблює полярність зв’язку О – Н і тим в більшій степені, чим більший вуглеводневий радикал. Тому в гомологічному ряду кислот їх сила зменшується з ростом числа атомів вуглецю в молекулі. 2. Утворення солей: а) взаємодія з активними металами: 2НСООН + Мg → (HCOO)2Mg + H2↑; Форміат магнію б) взаємодія з основними оксидами: 2СН3СООН + СаО → (СН3СОО)2Са + Н2О; Ацетат кальцію в) взаємодія з лугами (реакція нейтралізації): СН3СН2СООН + КОН → СН3СН2СООК + Н2О; Пропіонат калію г) взаємодія з аміаком або гідроксидом амонію: СН3СООН + NH3 → CH3COONH4; Ацетат амонію CH3COOH + NH4OH → CH3COONH4 + H2O; д) взаємодія з солями більш слабких кислот (карбонатами і гідро- карбонатами): 2СН3СООН + Na2CO3 → 2CH3COONa + CO2 + H2O; Ацетат натрію СН3СН2СН2СООН + NaHCO3 → CH3CH2CH2COONa + CO2 + H2O. Бутират натрію ІІ. Реакції з розривом зв’язку С – О ( заміщення ОН-групи) 1. Взаємодія з спиртами з утворенням складних ефірів (естерів) (реакція естерифікації): 2.Взаємодія з аміаком з утворенням амідів кислот. Аміди одержують з карбонових кислот і аміаку через стадію утворення амонійної солі, яку потім нагрівають:
3. Взаємодія з галогенідами фосфору (РСІ3, РСІ5) або тіонілхлоридом SOCI2 з утворенням галогенангідридів карбонових кислот:
4. Міжмолекулярна дегідратація карбонових кислот з утворенням ангідридів. Ангідриди одержують при пропусканні парів кислот над каталізатором водо- віднімаючим засобом):
Змішані ангідриди карбонових кислот можна одержати при взаємодії хлорангідрида однієї кислоти і солі іншої кислоти:
ІІІ. Реакції з розривом зв’язків С − Н біля α−вуглецевого атома (реакції з участю радикала). Атоми водню біля α−вуглецевого атома більш рухливі, ніж інші атоми водню в радикалі кислоти, і можуть заміщуватись на атоми галогена з утворенням α−галогенкарбонових кислот:
|