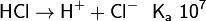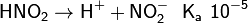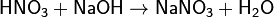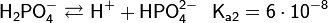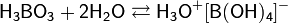Равновесные процессы в водных растворах
Химические свойства кислот определяются способностью их молекул диссоциировать в водной среде с образованием гидратированных ионов H+ и анионов кислотных остатков А–:
В зависимости от значения константы химического равновесия, также называемой константой кислотности Ka[2], выделяют сильные и слабые кислоты:
Из числа распространённых кислот к сильным относятся хлорная, азотная, серная и хлороводородная. Азотистая HNO2, угольная H2CO3 (CO2·H2O), фтороводородная HF – примеры слабых кислот. Также используется более детальная классификация по значению Ka на очень слабые (≤10-7), слабые (~10-2), средней силы (~10-1), сильные (~103), очень сильные (≥108). Для неорганических кислородсодержащих кислот вида HnXOm известно эмпирическое правило, по которому значение первой константы связано со значением (m – n). При (m – n) = 0 кислота очень слабая, при 1 - слабая, при 2 - сильная, и, наконец, при 3 - кислота очень сильная[3]:
3)Данная закономерность обусловлена усилением поляризации связи Н-О вследствие сдвига электронной плотности от связи к электроотрицательному атому кислорода по подвижным π-связям Э=O и делокализацией электронной плотности в анионе. Неорганические кислоты обладают свойствами, общими для всех кислот, среди которых: окрашивание индикаторов, растворение активных металлов с выделением водорода (кроме HNO3), способность реагировать с основаниями и основными оксидами с образованием солей, например:
Число атомов водорода, отщепляемых от молекулы кислоты и способных замещаться на металл с образованием соли, называется основностью кислоты. Кислоты можно разделить на одно-, двух- и трехосновные. Кислоты с более высокой основностью неизвестны. Одноосновными являются многие неорганические кислоты: галогеноводородные вида HHal, азотная HNO3, хлорная HClO4, роданистоводородная HSCN и др. Серная H2SO4, хромовая H2CrO4, сероводородная H2S служат примерами двухосновных кислот и т. д. Многоосновные кислоты диссоциируют ступенчато, каждой ступени отвечает своя константа кислотности, причем всегда каждая последующая Кa меньше предыдущей ориентировочно на пять порядков. Ниже показаны уравнения диссоциации трехосновной ортофосфорной кислоты:
Основность определяет число рядов средних и кислых солей − производных кислоты[4]. К замещению способны только атомы водорода, входящие в состав гидроксигрупп −OH, поэтому, например, ортофосфорная кислота H3PO4 образует средние соли - фосфаты вида Na3PO4, и два ряда кислых − гидрофосфаты Na2HPO4 и дигидрофосфаты NaH2PO4. Тогда как, у фосфористой кислоты H2(HPO3) только два ряда − фосфиты и гидрофосфиты, а у фосфорноватистой кислоты H(H2PO2) − только ряд средних солей − гипофосфитов. Исключение составляет борная кислота H3BO3, которая в водном растворе существует в виде одноосновного гидроксокомплекса:
Современные теории кислот и оснований значительно расширяют понятие кислотных свойств. Так, кислота Льюиса — вещество, молекулы или ионы которого способны принимать электронные пары, в том числе и не содержащие ионов водорода: например, катионы металлов (Ag+, Fe3+), ряд бинарных соединений (AlCl3, BF3, Al2O3, SO3, SiO2). Протонные кислоты рассматриваются теорией Льюиса как частный случай класса кислот. Все пероксокислоты и многие кислородсодержащие кислоты (азотная HNO3, серная H2SO4, марганцовая HMnO4, хромовая Н2CrO4, хлорноватистая HClO и др.) — сильные 4)окислители. Окислительная активность этих кислот в водном растворе выражена сильнее, чем у их солей; при том окислительные свойства сильно ослабевают при разбавлении кислот (например, свойства разбавленной и концентрированной серной кислоты). Неорганические кислоты также всегда менее термически устойчивы, чем их соли. Указанные различия связаны с дестабилизирующим действием сильнополяризованного атома водорода в молекуле кислоты. Наиболее выразительно это проявляется в свойствах кислородсодержащих кислот-окислителей, например, хлорной и серной. Этим же объясняется невозможность существования вне раствора ряда кислот при относительной стабильности их солей. Исключение составляет азотная кислота и её соли, проявляющие сильно выраженные окислительные свойства вне зависимости от разбавления раствора. Такое поведение связано с особенностями строения молекулы HNO3.
|

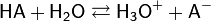
 (упрощённая запись)
(упрощённая запись)