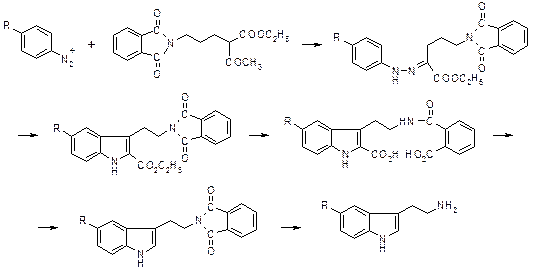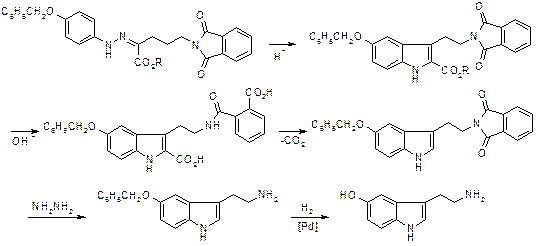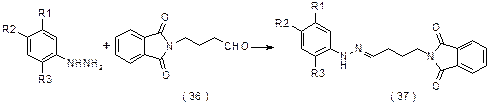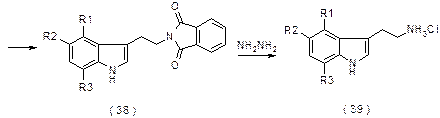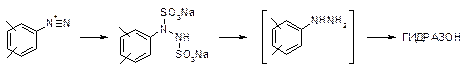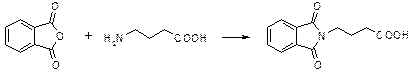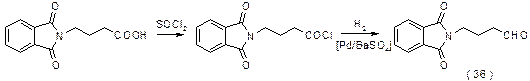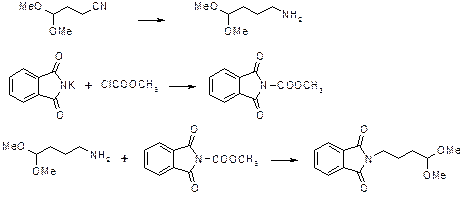Синтезы вторичных метаболитов триптофана
путем создания индольного ядра с боковой аминоалкильной цепью в ходе реакции
Для синтеза биологически активных производных индола по реакции Джеппа-Клингемана используют 2-алкилацетоуксусный эфир, содержащий функциональную группу в алкильном заместителе.
Кроме защищенной аминогруппы были использованы диметиламино-, карбэтокси-, цианогруппы и галоген производные. Подобным образом был получен серотонин (20).
Описанный синтез 5-гидрокситриптамина пригоден для работы с относительно большими количествами и использует в качестве исходных соединений легко доступные исходные вещества. Этил-a-ацетил-d-фталимидовалерат, получают с 96% выходом из 3-фталимидопропилбромида и ацетоуксусного эфира. Затем проводят конденсацию с п -бензилоксифенилдиазоний хлоридом в присутствии ацетата натрия; образующийся фенилгидразон (90%) циклизуется при насыщении кипящего этанольного раствора хлористым водородом, давая этил-5-бензилокси-3-(2’-фталимидоэтил)индол-2-карбоксилат с выходом 51-58%. Щелочной гидролиз эфира дает 98% выход дикислоты, которая при 240-250°, циклизуясь, повергалась сопутствующему декарбоксилированию и дегидратации, давая 5-бензилокси-3-(2’-фталимидоэтил)индол с выходом 84%. 5-Бензилокси-3-(2’-фталимидоэтил)индол был превращен в 5-бензилокситриптамин с выходом до 73% действием гидразин гидрата в кипящем этаноле. Восстановительное дебензилирование в присутствии палладия на угле дало 5-гидрокситриптамин.
Несмотря на легкую доступность исходных соединений и высокие выходы на отдельных стадиях метод имеет ограничения при синтезе триптаминов с некоторыми заместителями в бензольном кольце, например нитрогруппа. Более удобный и универсальный метод использует в качестве исходных соединений соответствующим образом замещенные гидразины и g-фталимидомасляный альдегид:
В качестве циклизующего агента предлагается использовать кипящий раствор сульфосалициловой кислоты в уксусной кислоте. Применение этого реагента обеспечивает условия, при которых гидразон вступает в реакцию практически мгновенно, а выделяющееся тепло отводится за счет теплоты испарения растворителя. Это дает возможность регулировать интенсивность процесса скоростью прибавления гидразона и применять значительные загрузки последнего. При охлаждении фталимидотриптамины выделяются в довольно чистом состоянии. Декарбоксилирование при этом способе не требуется. Фталимидная защитная группа удаляется гидразинолизом в достаточно мягких условиях. При получении исходных фенилгидразинов восстановлением диазониевых солей сульфитом натрия, стадия гидролиза дисульфокислоты может быть совмещена с образованием гидразона:
g-Фталимидомасляный альдегид синтезируют из g-аминомасляной кислоты путем фталилирования и превращения в хлорангидрид с последующим восстановлением по Розенмунду. Вместо альдегида можно использовать его ацеталь, например, диметиловый. Условия проведения реакции и выходы при этом не изменяются.
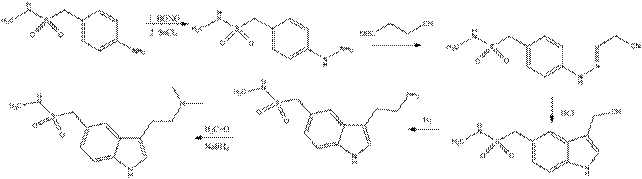
Синтетические лекарственные средства – аналоги триптаминов. Суматриптан Препарат разработан Glaxo Group в 1989 для лечения мигрени. Описанный в патенте (U.S. Patent 4,785,016) синтез протекает по схеме:
Лекция 14 Простагландины – низкомолекулярные биорегуляторы производные арахидоновой кислоты. Полный синтез простагландинов, как основа химического производства лекарственных средств.
|