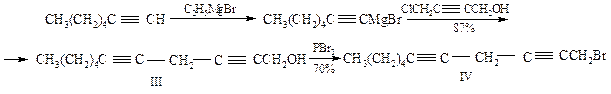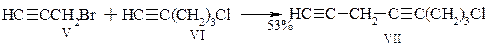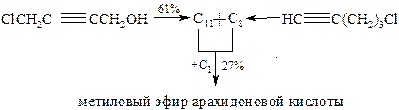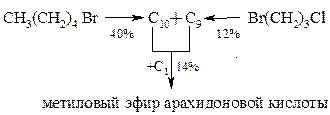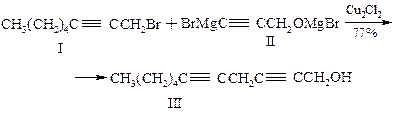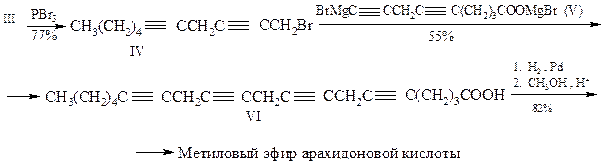Химический синтез арахидоновой кислоты
В свое время проблема разработки химического синтеза арахидоновой кислоты являлась чрезвычайно важной проблемой, поскольку выделение этой кислоты из коры надпочечников представляет значительные трудности, а растительных источников арахидоновой кислоты пока не обнаружено. К настоящему времени описаны три синтеза арахидоновой кислоты, имеющих практическое значение. Метод Генслера:
В этом методе исходным соединением является гептин-1 (I). Обработкой его этилмагнийбромидом получают магнийорганическое производное II, которое при конденсации в молярном соотношении 2:1 с 4-хлорбутин-2-олом-1 образует непредельный спирт III. Эту и все последующие реакции проводят в тетрагидрофуране при комнатной температуре в присутствии каталических количеств однохлористой меди. Непредельный спирт III превращают в соответствующий бромид IV, представляющий собой основу фрагмента синтезируемой молекулы арахидоновой кислоты с метильного конца молекулы. Второй фрагмент карбоксильного конца молекулы получают при взаимодействии 3-бромпропина V с 5-хлорпентином VI:
Конденсация бромида IV с октадиином VII приводит к образованию С19-хлорида VIII. Последний избирательно гидрирует (катализатор Линдлара) до соединения IX, превращают в магнийорганическое производное, обрабатывают двуокисью углерода и наконец метилируют. В итоге получают метиловый эфир арахидоновой кислоты X.
Рассмотренный путь синтеза может быть представлен в общем виде следующей схемой:
Рахлин и сотрудники синтезировали метиловый эфир арахидоновой кислоты, применив аналогичные реакции, но по несколько иной схеме:
В третьем методе синтеза, разработанном Осбондом, использован путь, принципиально применимый также для получения линоленовой и g-линоленовой кислот, а также обсуждаемой арахидоновой кислоты.
Первая стадия синтеза заключается в получении спирта III при взаимодействии 1-бромоктина-2 (I) c димагнийпроизводным пропаргилового спирта II. Реакцию проводят в тетрагидрофуране в присутствии однохлористой меди. Такой путь дает лучшие результаты, чем взаимодействие пропаргилового спирта с дигидропираном с последующим добавлением этилмагнийбромида, в результате чего получается соединение которое быть использовано для конденсации с соединением I.
Далее непредельный спирт III превращают бромид IV и последний конденсируют с димагнийорганическим производным V, полученным из нонандиин-5,8-овой кислоты. Конденсацию проводят в тетрагидрофуране при 20°С в присутствии цианистой меди как катализатора. Образующуюся тетраиновую кислоту VI (т.пл. 82 °С) подвергают селективному гидрированию (катализатор Линдлара) и после этерификации получают метиловый эфир арахидоновой кислоты. Общий выход составляет 27%. Нонадиин-5,8-овая кислота была получена с выходом 60% взаимодействием пропаргилбромида с гексин-5-овой кислотой. Данный синтез метилового эфира арахидоновой кислоты был опубликован раньше других (1959) и, по мнению Рахлина, он "имеет и наибольшее промышленное значение, поскольку промежуточный продукт С20-тетраиновая кислота VI является твердым, довольно устойчивым соединением".
|