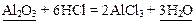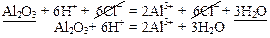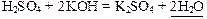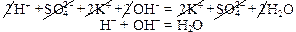Образование неэлектролита или слабого электролита
Пример 5: Al2O3 – оксид (неэлектролит), Н2O – слабый электролит.
Пример 6: Н2O – слабый электролит
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Цель работы: Изучить условия протекания ионообменных реакций. Оборудование и реактивы: Растворы (0,5н): гидроксида натрия NaOH, гидроксида бария Ba(OH)2, хлорида железа(III) FeCl3, сульфата натрия Na2SO4, сульфата меди CuSO4, сульфата никеля NiSO4, хлорида бария BaCl2, соляной кислоты HCl, хлорида кобальта CoCl2, уксусной кислоты СН3СООН, нитрата свинца Pb(NO3)2, йодида калия KJ. Гранулированный цинк. Пробирки. Зажим для пробирок. Спиртовка.
Опыт № 1. Получение нерастворимых оснований. В первую пробирку налить 1 мл раствора гидроксида натрия. Во вторую – 1 мл раствора гидроксида бария. Добавить в каждую пробирку по 2 капли раствора FeCl3. Отметить цвет образующегося осадка в обоих случаях. þ Запись результатов опыта: 1. Написать уравнения реакций в молекулярной и сокращенной ионной формах. 2. Записать наблюдаемые явления. 3. Записать ионное уравнение, отражающее суть реакции, происходящей в обеих пробирках.
Опыт № 2. Получение нерастворимых солей. В первую пробирку налить 1 мл раствора сульфата натрия. Во вторую – 1 мл раствора сульфата меди. В третью – 1 мл раствора сульфата никеля. В каждую пробирку добавить несколько капель раствора хлорида бария. Дать осадкам отстояться и отметить их цвета. þ Запись результатов опыта: 1. Написать уравнения реакций в молекулярной и сокращенной ионной формах. 2. Записать наблюдаемые явления. 3. Записать общее ионное уравнение для всех реакций.
Опыт № 3. Растворение осадков гидроксидов металлов в кислотах. В четырех пробирках получить осадки Fe(OH)3, Co(OH)2, Ni(OH)2 и Cu(OH)2, действуя щелочью на растворы соответствующих солей. Добавить в каждую пробирку по 1 мл раствора соляной кислоты. Наблюдать растворение осадков. þ Запись результатов опыта: 1. Написать уравнения всех проделанных реакций в молекулярной и сокращенной ионной формах. 2. Записать цвет исходных осадков и наблюдаемые явления. 3. Различается ли цвет растворов до выпадения осадков и после их растворения? Наличие каких ионов в этих растворах обуславливает их окраску?
Опыт № 4. Получение газообразных веществ.
|