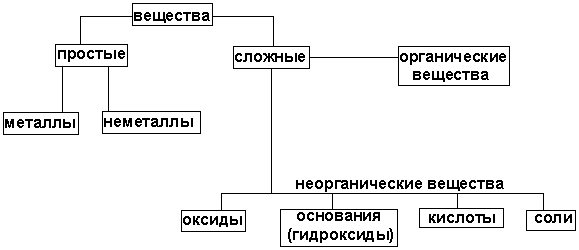
Важнейшие классы неорганических соединений, их характеристика и номенклатура.
Билет №4. Сложные вещества обычно делят на четыре важнейших класса: оксиды, основания (гидроксиды), кислоты, соли
Оксид (окисел, окись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менееэлектроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2. Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок,углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом (см. Окислы). Соединения, содержащие атомы кислорода, соединённые между собой, называются пероксидами (перекисями) и супероксидами. Они не относятся к категории оксидов. Классификация В зависимости от химических свойств различают: § Солеобразующие оксиды: § основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II; § кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов; § амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO); § Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO. [править]Номенклатура В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 —оксид хлора(VII). Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, моноокисью или закисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3. Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д. В начале XIX века и ранее тугоплавкие, практически не растворимые в воде оксиды химики называли «землями» Гидрокси́ды (гидроо́киси) — соединения оксидов химических элементов с водой. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами. [править]Классификация В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают: § основные гидроксиды (основания) — гидроксиды, проявляющие основные свойства (например, гидроксид кальция Ca(ОН)2, гидроксид калия KOH, гидроксид натрия NaOH и др.); § кислотные гидроксиды (кислородосодержащие кислоты) — гидроксиды, проявляющие кислотные свойства (например, азотная кислота HNO3, серная кислота H2SO4,сернистая кислота H2SO3 и др.) § амфотерные гидроксиды, проявляющие в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия Al(ОН)3, гидроксид цинкаZn(ОН)2). Термин «гидроксиды» часто применяют только по отношению к основным и амфотерным гидроксидам.
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония Типы солей § Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример: § Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример: § Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример: § Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример: § Смешанные соли — в их составе присутствует два различных аниона. Пример: § Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: § Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример: Особую группу составляют соли органических кислот, свойства которых значительно отличаются от свойств минеральных солей. Некоторые из них можно отнести к особенному классу органических солей, так называемых ионных жидкостей или по-другому «жидких солей», органических солей с температурой плавления ниже 100 °C. Названия солей Названия солей образуются из двух слов: название аниона в именительном падеже и название катиона в родительном падеже: — сульфат натрия. Для металлов с переменной степенью окисления её указывают в скобках и без пробела: — сульфат железа(II), — сульфат железа(III). Названия кислых солей начинаются с приставки «гидро-» (если в соли присутствует один атом водорода) или «дигидро-» (если их два). Например, Названия основных солей начинаются с приставки «гидроксо-» или «дигидроксо-». Например, В гидратных солях на наличие кристаллической воды указывает приставка «гидрат-». Степень гидратации отражают численной приставкой. Например, На низшую степень окисления кислотообразующего элемента (если их больше двух) указывает приставка «гипо-». Приставка «пер-» указывает на высшую степень окисления (для солей кислот с окончаниями «-овая», «-евая», «-ная»). Например: Кислоты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
|

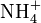 ; известны соли фосфония
; известны соли фосфония 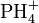 илигидроксония
илигидроксония 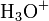 ) и анионов кислотного остатка.
) и анионов кислотного остатка.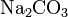 ,
,  .
.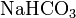 ,
, 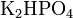 .
. .
.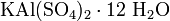 .
.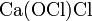 .
.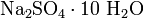 .
.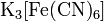 ,
,  .
.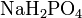 — дигидрофосфат натрия.
— дигидрофосфат натрия.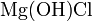 — гидроксохлорид магния,
— гидроксохлорид магния, 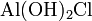 — дигидроксохлорид алюминия.
— дигидроксохлорид алюминия.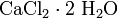 — дигидрат хлорида кальция.
— дигидрат хлорида кальция. — гипохлорит натрия,
— гипохлорит натрия, 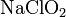 — хлорит натрия,
— хлорит натрия, 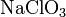 — хлорат натрия,
— хлорат натрия,  —перхлорат натрия.
—перхлорат натрия.


