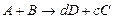Основы кинетики хим реакций
Кинетика-закономерность протекания хим. реакций.Гомогенная смесь-в-во и окислитель находится в газообразной фазе.Гетерогенная смесь- в-во наход в жидк или тв. фазе, а окислитель- газ (О2) (сжигание мазута или тв топлива)аА+bВ=dD+eEa,b,d,e – кол-во молей вступ в реакциюА,В,D,E – в-ва вступ в реакцию. Когда происходит горение газа, то концентрации горюч элементов уменьшается и следовательно пламя гаснет.Концентрация- кол-во молей в-ва в ед. объема. Интенсивность реакции хар-ся величиной изменения концентраций в-в реагирующих. · скорость реакции
В основе учения скорости протекания реакции лежит закон действующих масс - скорость реакции в каждый момент времени пропорционально произведению концентраций реагирующих в-в в гомогенной системе.
Реакция, которая идет слева на право – прямая реакция (реакция окисления),реакция, которая идет справа на лево- обратная реакция (реакция восстановления) Если скорость обратной реакции соизмерима со скоростью прямой реакции, то фактически полное горение не произойдет и в составе конечных продуктов останутся компоненты исходные. Результирующая скорость= скорость прямой реакции- скорость обратной реакции
каждая протекающая реакция м.б.мономолекулярной - реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.): 1) бимолекулярной- реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
2) тримолекулярной - реакции, элементарный акт которых осуществляется при столкновении трех частиц: О2 + NО + NО → 2NО2
|

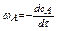 (изменение концентраций в-ва А во времени. (минус показывает, что уменьшается концентрация))
(изменение концентраций в-ва А во времени. (минус показывает, что уменьшается концентрация)) (предполагаем, что реакция протекает слева на право)
(предполагаем, что реакция протекает слева на право)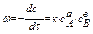 , где к- коэффициент скорости,а,в- кол-во молекул вступ в реакцию.Горение водорода:2Н2+О2=2Н2О -закон действующих масс.
, где к- коэффициент скорости,а,в- кол-во молекул вступ в реакцию.Горение водорода:2Н2+О2=2Н2О -закон действующих масс. 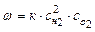
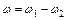 , если
, если 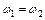 то
то 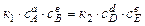 ,
, 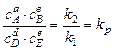 -константа равновесия.
-константа равновесия. 
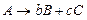 (реакция разложения)
(реакция разложения)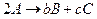 (2 молекулы в-ва)
(2 молекулы в-ва)