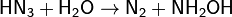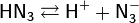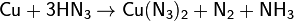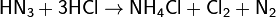ПОЛУЧЕНИЕ
· Хлорид нитрозила можно получать при непосредственном взаимодействии оксида азота с хлором. Он также образуется при нагревании смеси соляной и азотной кислот: · · Более удобным способом получения является нагревание нитрозилсерной кислоты с хлоридом натрия: ·
Азо́тистоводоро́дная кислота́;, азоими́д, HN3 — кислота, соединение азота с водородом. Бесцветная, летучая, чрезвычайно взрывоопасная (взрывается при нагреве, ударе или трении) жидкость с резким запахом. Очень токсична. Её хорошо растворимые соли тоже очень ядовиты. Механизм токсичности аналогичен цианидам (блокирование цитохромов). Разбавленные водные растворы не взрывоопасны, но при стоянии раствор HN3 медленно разлагается до азота и гидроксиламина:
В водном растворе HN3 проявляет свойства слабой кислоты (рKа = 4,59). По силе она близка к уксусной кислоте. Водный раствор HN3 называют азидоводородной кислотой (азотистоводородной кислотой). В растворах азидоводородная кислота диссоциирует на ионы:
Кислота HN3 является окислителем. При взаимодействии с металлами образует соль металла, азот и аммиак:
Соли этой кислоты называются азидами. При ударе или нагревании распадаются со взрывом, на чём основано применение азида свинца Pb(N3)2 в качестве инициирующего взрывчатого вещества. Относительно устойчивы ионные азиды щелочных металлов, за исключением LiN3. Смесь HN3 и соляной кислоты HCl подобно «царской водке» является сильным окислителем из-за образующегося хлора и растворяет золото и платину:
Кислота и её соли разлагаются при действии сильных окислителей с выделением азота. В органической химии применяется в реакции Шмидта.
|