Обучающие задачи.
1. Выпадает ли осадок при смешении равных объемов 10-4 М растворов Pb(NO)2 и Na2SO4? ПРPbSO4= 1,6∙10-8. Решение. В насыщенном растворе сульфата свинца устанавливается равновесие: PbSO4↔ Pb2+ + SO42- При смешении равных объемов указанных растворов солей концентрация каждого из них уменьшается вдвое и становится равной 5∙10-5 моль/л. В растворе концентрация ионов свинца равна концентрации сульфат-ионов: [Pb2+]=[SO42-] = 5∙10-5 моль/л. Ионное произведение ПИ: ПИ=[Pb2+]∙[SO42-] = 2,5∙10-9. Из расчета следует, что ПИ<ПР, т.е., раствор ненасыщенный, осадок не выпадает.
2. Растворимость AgSCN в воде составляет 1,035∙10-6 моль/л при 250С. Вычислить ПРAgSCN при данных условиях. Решение. В насыщенном растворе устанавливается следующее равновесие: AgSCN↔ Ag+ + SCN-, которое показывает: сколько молекул растворилось, перешло из осадка в раствор, сколько ионов каждого сорта образовалось. Если S (моль/л) – растворимость осадка, то концентрация молекул, перешедших в раствор, равна концентрации каждого из ионов: AgSCN↔ [AgSCN]p → Ag+ + SCN- Осадок S S S ПР AgSCN = [Ag+]∙[ SCN-] = S2 = (1,035∙10-6) = 1,07∙10-12.
3. Вычислить растворимость в (г/л) соли Ca5(PO4)3OH (М=502 г/моль), если известно, что Решение. В насыщенном водном растворе малорастворимый гидроксиапатит диссоциирует следующим образом: Ca5 (PO4)3OH ↔ 5Са2+ + 3РО43- + ОН-
Рассуждая аналогичным образом: Ca5 (PO4)3OH ↔ [Ca5 (PO4)3OH]p→ 5Ca2+ + 3PO43- + OH- Осадок S 5S 3S S ПР = (5S)5 · (3S)3 · S = 84375 S9
S =
4. Вычислить, как изменится растворимость ВаСrО4 в 2,0·10-3 М растворе Na2CrO4 по сравнению с растворимостью в чистой воде, если ПР ВаСrО4= 1,2·10-10. Решение. Растворимость ВаСrО4 в воде (S1) равна, согласно равновесию в насыщенном растворе: ВаСrО4 ↔ Ва2+ + СrО42- S1= [Ba2+]=[CrO42-]= В растворе Na2CrO4 (S2): S2 = [Ba2+] =
|

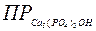 = 1,6∙10-58.
= 1,6∙10-58.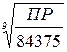 =
= 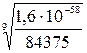 =1,074∙10-7∙502=5,39∙10-5 [г/л]
=1,074∙10-7∙502=5,39∙10-5 [г/л] = 1,1 ·10-5 моль/л
= 1,1 ·10-5 моль/л =
=  = 6·10-8 моль/л
= 6·10-8 моль/л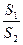 =
= 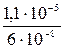 = 183 – растворимость уменьшится в 183 раза.
= 183 – растворимость уменьшится в 183 раза.


