Відносна вологість повітря та точка роси.
Як в рідинах (нижче температури кипіння), так і в кристалічних тілах є деяка кількість молекул енергія яких достатня для переходу в газуватий стан. Таким чином при любій температурі над рідиною чи кристалом є газувата фаза тиск якої залежить від температури. Наприклад для води залежність тиску насиченої пари над рідиною подана в таблиці:
Відносна вологість повітря – відношення маси водяної пари (або тиску) що реально знаходиться в повітрі до максимальної маси (або тиску) що може знаходитись в повітрі при заданій температурі виражена у відсотках. Абсолютна вологість повітря – маса водяної пари що знаходиться в 1м3 повітря. Точка роси – температура при якій відносна вологість повітря стане 100%. При охолодженні повітря нижче точки роси відбудеться конденсація води (випаде роса). 5. Критична температура Для зрідження газу необхідно зменшити температуру або збільшити тиск. Існує температура вище якої газ ні при якому тиску не може перетворитись у рідину. Ця температура називається критичною. tкрит.(О2) = -118,8°С Ркрит.=50,3 атм. Vкрит.= 0,078 л. tкрит.(СО2) = +31,3°С Ркрит.=73,8 атм. Vкрит.= 0,094 л. tкрит.(Н2О) = +374,2°С Ркрит.=221атм. Vкрит.= 0,056 л. 6. Фазові рівноваги та правило фаз Гіббса. Фазові рівноваги – це рівноваги, що спостерігаються в гетерогенних системах, в яких не відбувається хімічної реакції, а мають місце лише фазові переходи. Фаза (Ф) – це сукупність усіх частин системи, які мають однаковий склад та однакові термодинамічні властивості, але відділені одна від одної поверхнею розділу. Бувають однофазні системи, двохфазні трьохфазні.. Наприклад сім кусочків льду – це однофазна система. Вода в якій плаває три кусочки льду та 2 шматочки крейди – трьхфазна система. Складова – це індивідуальна хімічна речовина, яку можна виділити з системи і вона існуватиме самостійно. Компонент (К) – це мінімальна кількість складових, необхідних та достатніх для утворення всіх можливих фаз даної системи. Ступінь свободи – один із декількох параметрів системи, що перебувають у стані рівноваги, зміна якого не викликає утворення інших фаз або знищення вже існуючих. Число ступенів свободи (С)- це кількість незалежних параметрів системи які можна змінювати без зміни кількості фаз в системі. Якщо у системі не відбувається хімічна реакція, то кількість компонентів дорівнює кількості складових. Якщо окрім фазових перетворень мають місце хімічні реакції, то кількість компонентів дорівнює різниці між кількостю складових та кількістю рівнянь реакцій що повязують концентрації даних речовин. Правило фаз Гіббса. У термодинамічній системі що знаходиться в рівновазі виконується рівняння: С = К – Ф + n Де n – число можливих термодинамічних факторів. Якщо з усіх термодинамічних факторів діє лише температура то С = К – Ф + 1 Якщо з усіх термодинамічних факторів діє лише температура та тиск то С = К – Ф + 2 7. Рівняння Клапейрона –Клаузіуса та його використання для аналізу фазових діаграм.
Розглянемо процеси плавлення та випаровування в однокомпонентних системах. Процес плавлення як і процес кипіння завжди ендотермічний (йде з поглинанням енергії). Тобто Для процесів плавлення можливі два випадки. Якщо Якщо Для процесів кипіння. При кипіння завжди об’єм збільшується.
Наприклад вода при 760 мм.рт.ст. кипить при 100 градусах Цельсія Але зменшивши тиск до 20 мм.рт.ст можна зменшити температуру кипіння води до кімнатної. Це використовують на практиці. Або в автоклавах для стерилізації при 120 градусах Цельсія використовують підвищений тиск.
8. Контрольні питання
|

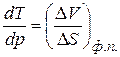 або
або 
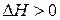
 > 0 то
> 0 то  теж > 0. Це означає що підвищення тиску супроводжується підвищенням температури плавлення. Це характерно для більшості речовин.
теж > 0. Це означає що підвищення тиску супроводжується підвищенням температури плавлення. Це характерно для більшості речовин.


