Блок автоматичного титрування.
Хімічний посуд, що застосовується в титрометрії: Колби конічні – для проведення процесу титрування, Колби мірні – для приготування титрованих розчинів та розведення розчинів до точно відомого обєму, Піпетки – для дозування та перенесення точних обємів розчинів. Методи титриметрії класифікують за типом реакції покладеної в основу методу або за робочим розчином методу. Основні методи титрометрії: кислотно-основне титрування (метод нейтралізації) розрізняють: ацидометричне титрування – використовують для визначення речовин з основною функцією. Робочим розчином в ацидиметрії є 0,1 н. хлоридної або сульфатної кислоти алкаліметричне титрування – використовують для визначення речовин з кислотною функцією. Робочим розчином в алкаліметрії є 0,1 н. розчин лугу. Окисно-відновне титрування (редоксиметрія) – титрування окисника відновником або відновника окисником. перманганатометричне титрування – використовують для визначення відновників. Робочий розчин розчин сильного окисника - калій перманганату. Титрування проводять в кислому середовищі. йодометричне титрування- титрування з застосуванням розчину йоду або з додаванням калій йодиду з утворенням йоду.Йод відтитровують розчином натрій тіосульфату. броматометричне титрування – ґрунтується на реакції окиснення різних відновників бромат іонами у кислому середовищі. Отже, титр антом є розчин калій бромату. нітритометричне титрування – ґрунтується на реаціях діазотування органічних сполук натрій нітритом. Використовують для аналізу речовин з аміногрупою. Осаджувальне титрування. Визначають речовини коли в результаті реакції відбувається кількісне осадження речовини що визначається в вигляді осаду, а саме: аргентометрія сульфатометрія Комплексометричне титрування. Основане на використанні реакцій комплексоутворення. Розрізняють пряме, зворотнє та непряме титрувааня. При прямому титруванні титрант додають до аналізуємого розчину до досягнення точки еквівалентності. При зворотньому титруванні використовують два титранти. Спочаток до аналізуємого розчину додають надлишок (точно відомий обєм) першого титранта. Частково цей титрант реагує з речовиною, що аналізується. А потім надлишок першого титранта відтитровується другим титрантом. При непрямому титрування до розщину, що аналізується додають реагент, який реагує з аналізуємою речовиною, а потім продукт цієї реакції відтитровують.
2. Метод нейтралізації Цей метод використовують для кількісного визначення кислот, лугів, а також солей, розчини яких унаслідок гідролізу мають кислотну або лужну реакцію. В ацидиметрії визначають розчини, які мають лужну реакція, в алкаліметрії – кислу реакцію. Точку еквівалентності фіксують по зміні рН розчину. Для візуалізації точки еквівалентності використовують індикатори кислотно-основного титрування. Ці індикатори змінюють колір при зміні рН розчину. Зміна кольору відбувається в деякому інтервалі рН середовища, який називається інтервалом переходу індикатора. Існує велика кількість індикаторів кислотно-основного титрування (їх характеристика є в довідниках з аналітичної хімії). Кожний індикатор має свій інтервал переходу індикатора – це область зміни рН в якій індикатор змінює свій колір Індикатори також характеризуються показником титрування рТ який є серединою інтервалу переходу індикатору. Найбільш широко вживані індикатори:
Існують різні випадки кислотно-основного титрування які обумовлюють вибір того чи іншого індикатора. Для визначення кінця титрування необхідно взяти такий індикатор, який змінює своє забарвлення в межах стрибка титрування. 1. Титрування сильної кислоти лугом (або навпаки). Крива титрування сильної кислоти лугом (залежність рН розчину від доданого об’єму титранту) в цьому випадку має вигляд:
Крива титрування лугу розчином сильної кислоти є дзеркальним відображенням наведеної кривої. Оскільки в цьому випадку стрибок титрування великий (рН змінюється від 3 до 11), можна використовувати будь який індикатор, інтервал переходу якого лежить у цих межах рН. Точка еквівалентності відповідає рН =7. 2. Титрування слабкої кислоти лугом. Крива титрування в цьому випадку має вигляд:
Стрибок титрування значно менший (від рн 7,5 до 10,5). Середина лежить при рН=9. Для визначення кінця точки еквівалентності використовують фенолфталеїн або тимолфталеїн. 3. Титрування слабкої основи сильною кислотою. Крива титрування в цьому випадку має вигляд:
Стрибок титрування в межах від рн 6,2 до 3,8). Середина лежить при рН=5. Для визначення кінця точки еквівалентності використовують метиловий оранжевий або метиловий червоний. 4. Титрування слабкої кислоти слабкою основою.
В цьому випадку стрибок титрування малопомітний, різкої зміни забарвлення індикатора не спостерігається, точку еквівалентності виявити складно. Тому таку систему на практиці не використовують.
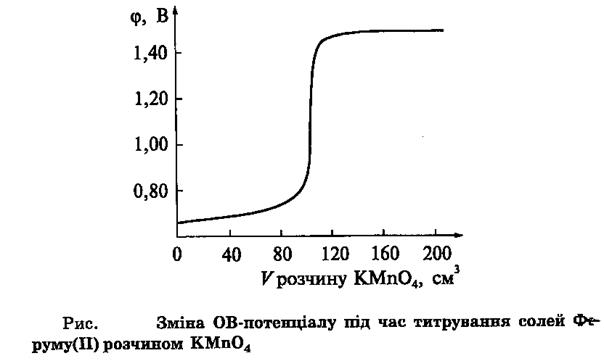
3. Метод оксидиметрії Методи обємного аналізу, що ґрунтуються на застосуванні окисно-відновних реакцій, називають оксидиметрією серед них перманганатометрія, йодометрія, броматометрія, нітратометрія. В перманганатометрії робочий розчин калій перманганат. Титрування ведуть в кислому середовищі з попереднім додаванням у колбу для титрування 10-20 мл. розбавленого розчину сульфатної кислоти. Використовують для визначення відновників. В точці еквівалентності розчин набуває кольору калій перманганату (до точки еквівалентності розчин прозорий), тому індикатор не потрібний. При розчиненні калій перманганату у воді може змінювати свою концентрацію за рахунок окислення мікрокількостей органічних речовин, що знаходяться у воді, тому робочий розчин калій перманганату готують за декілька днів заздалегідь та остаточно встановлюють титр або нормальність розчину безпосередньо перед аналізом титруючи його розчином оксалатної кислоти точно відомої концентрації. Концентрація розчину калій перманганату може також змінюватись під дією світла або при дуже довгому стоянні розчину. Враховуючи що у сильнокислому середовищі манган у калій перманганаті змінює свій ступень окислення з плюс 7 на плюс два (приймає 5 електронів) еквівалентна маса розчину калій перманганату буде у 5 разів менше ніж його молярна маса. В інших випадках точку еквівалентності фіксують по зміні окисно-відновного потенціалу (редокс-потенціалу). Для цього можна використовувати індикатори окисно-відновного титрування. Ці індикатори змінюють свій колір при зміні окисно-відновного потенціалу системи. Дифеніламін – перехід від безколірного до синього Е0 = 0,76 В. Використовують розчин в концентрованій сульфатній кислоті. Фенілантранілова кислота. Перехід від безколірного до червоно-фіолетового. Е0 = 1,08 В. Використовують розчин в сульфатній кислоті. Специфічні індикатори: Крохмаль – стає синім при наявності вільного йоду. Використовують в йодометрії. Розчин калій перманганату. В точці еквівалентності розчин більше не знебарвлюється. Використовують в перманганатометрії. Кожний індикатор має свій інтервал переходу індикатора – це область зміни окисно-відновного потенціалу, в якій індикатор змінює свій колір Індикатори також характеризуються показником титрування рТ який є серединою інтервалу переходу індикатору. В оксидиметрії крива титрування виражається в координатах зміни окисно-відновного потенціалу системи від об’єму титранта.
В йодометрії визначення відновників проводять прямим титруванням робочим розчином йоду, або методом зворотнього титрування. Суть зворотнього титрування в тому, що до певного об’єму розчину відновника додають надлишок титрованого розчинц йоду, а потім йод що не прореагував, титрують робочим розчином натрій тіосульфату (відновника). Кількісне визначення окисників в йодометрії здійснюють так: до підкисленого розчину окисника додають надлишок розчину калій йодиду. В результаті реакції утворюється еквівалентна кількість йоду, який потім відтитровують розчином натрій тіосульфату. За об’ємом розчину натрій тіосульфату що пішов на титрування можна визначити кількість окисника в досліджуваному розчину. 4. Інші методи титриметрії В методах осадження (коли в результаті реакції утворюється осад) крива титрування виражається в координатах зміни відємного логарифму концентрації осаджувача від об’єму титранту. Але в усіх випадках вони нагадують криву титрування в методі нейтралізації.
Найчастіше використовують аргентометрію, яка дозволяє визначити галогенід та роданід йони осаджуючи їх розчином аргентум нітрату. Аргентометричне титрування можна проводити двома способами: А) прямим титруванням (методи Мора і Фаянса), Б) зворотнім титруванням (метод Фольгарда). У першому випадку точку еквівалентності встановлюють за допомогою калій хромату або адсорбційних індикаторів. При зворотньому титрування надлишок аргентум нітрату титрують розчином амоній або калій роданіду за наявності у якості індикатора йонів Ферум (+3). Робочими розчинами в методі аргентумметрії є розчини аргентум нітрату і калій (амоній) роданіду. В методі комплексонометрії (коли в результаті реакції утворюється комплексна сполука) використовують титранти, що утворюють комплексні сполуки йонів металів з спеціальними органічними сполуками які називають комплексонами. Найбільш широко використовують робочий розчин ЕДТА або трилон Б. Як правило точку еквівалентності встановлюють за допомогою спеціальних металохромних індикаторів які реагують на зміну концентрації йонів металів у розчинах і змінюють свій колір при досягненні точки еквівалентності. В більшості випадків титрування необхідно проводити при точно визначеному сталому рН розчину. Тому у колбу для титрування додають також буферну суміш. Найбільш широко вживані індикатори єріохром чорний Т, мурексид, кислотний хромовий темно-синій.
5. Контрольні питання 1. Суть титриметричного аналізу. 2. Точка еквівалентності. 3. Розрахунки в титриметрії. 4. Фіксація точки еквівалентності за допомогою приладів. 5. Установка для титрування. 6. Основні методи титриметрії. 7. Метод нейтралізації, індикатори методу нейтралізації. 8. Титрування сильної кислоти лугом. 9. Титрування слабої кислоти лугом. 10. Титрування слабкої основи кислотою. 11. Титрування слабкої кислоти слабкою основою. 12. Інші методи титриметії.
|