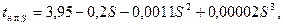Физические свойства воды
ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ, ВОДЯНОГО ПАРА, ЛЬДА И СНЕГА Физические свойства воды 1. Плотность воды. В физике плотность неоднородной сплошной среды — предел отношения массы вещества этой среды m к объему V, в котором она заключена:
(2.1)
Плотность однородной сплошной среды определяется массой вещества этой среды в единице объема: ρ = m / V. (2.2) Плотность воды, как и всякого другого вещества, является функцией температуры и давления, т. е. ρ = f(t, P) (2.3) Обычно функция (2.3) определяется экспериментально и выражается в виде таблицы или формулы. Плотность воды изменяется с температурой сравнительно незначительно. Поэтому в большинстве случаев в практических расчетах ее значение может быть принято постоянным: ρ = 1000 кг/м3. Более точное значение плотности учитывается тогда, когда изучаемый процесс зависит от разности плотностей Dr, например свободная конвекция, первопричина которой – разность плотностей по глубине воды. Плотность соленой воды превышает плотность дистиллированной воды и зависит от состава растворенных солей и общей солености S. Общая соленость морской воды не превосходит 40‰, тогда как в соленых озерах она достигает 250 — 300‰. Сжимаемостью жидкости (воды) называется свойство уменьшения объема под влиянием повышения внешнего давления. Величиной, обратной сжимаемости, является объемная упругость.
(2.4)
Знак минус показывает, что увеличению давления соответствует уменьшение объема. Величину, обратную коэффициенту сжимаемости, называют модулем объемной упругости (модулем объемного сжатия): k = 1/β. (2.5) Приняв значение модуля объемной упругости для воды близким к его среднему значению и равным 2·109 Па, получим коэффициент сжимаемости β ≈ 5·10-10 1/Па. Определим теперь уменьшение объема 1м3 воды, перенесенного на глубину 1000м (Δ P ≈ 107 Па) с поверхности. Из формулы (2.4) имеем dV = β V 0 dP или Δ V = β V 0 Δ P, (2.6) где V 0 — единичный (удельный) объем воды на поверхности. Подставив соответствующие значения в уравнения (2.6), получим Δ V = 5·10-10· ·1·107 = 5·10-3 м3 (или 0,5%). Эти расчеты показывают, что вода очень мало сжимаема. Коэффициент β уменьшается при повышении температуры, солености и первоначального давления, под которым находилась вода до сжатия.
(2.7)
откуда V 2 = V 1 (1 + β t Δ t), (2.8) где Δ V = V 2 - V 1 — изменение объема жидкости; V 1 и V 2 — объемы жидкости соответственно при температуре t 1и t 2; Δ t = t 2 - t 1. Так как плотность воды максимальна при температуре t = 4°С (точнее 3,98°С), то при этой температуре β t = 0, а при температуре t < 4°С β t < 0, т.е. при нагревании объем не увеличивается, а, напротив, уменьшается, что является одной из физических аномалий воды. Таким образом, в связи с плотностной аномалией воды коэффициент ее объемного расширения имеет отрицательные значения при температуре от 0 до 4°С и положительные при температуре выше 4°С, причем с повышением температуры коэффициент β t увеличивается. По сравнению с другими жидкостями коэффициент объемного расширения воды сильно зависит от температуры. 2. Характерные значения температуры воды. Температура наибольшей плотности дистиллированной воды при нормальном давлении 1,01·105 Па обычно принимается равной 4°С, хотя точное ее значение 3,98°С. Особый интерес имеет зависимость этой температуры от давления. Обычно ее принимают линейной и записывают в следующем виде:
(2.9)
Нужно также иметь в виду, что дистиллированной воды в природе нет, а вода так называемых пресных озер и рек всегда немного минерализована. Например, концентрация солей воды оз.Байкал составляет 0,0697кг/м3. Поэтому для природных озер и искусственных водохранилищ температура наибольшей плотности воды всегда немного меньше 4°С. Значение коэффициента a для дистиллированной воды, по лабораторным данным, равно 0,0079°С/Па. Для температуры наибольшей плотности морской воды в зависимости от солености, может быть рекомендована формула Кнудсена — Крюммеля:
(2.10)
где S — соленость морской воды, ‰. Температура кристаллизации (замерзания) дистиллированной воды при нормальном атмосферном давлении принимается равной 0°С и служит начальным значением температурной шкалы термометра Цельсия. Процесс замерзания пресной и соленой воды происходит скачком с выделением теплоты кристаллизации. Обратный процесс, т. е. таяние льда, происходит с поглощением того же количества теплоты, но без скачка, постепенно. Температура замерзания морской воды при нормальном давлении может быть определена, например, по эмпирической формуле Крюммеля: t з = - (3·10-3 + 527·10-4 S + 4·10-5 S 2 + 40·10-6 S 3). (2.11) Формулой (2.11) можно пользоваться также для приближенного определения температуры замерзания минерализованных вод суши при малой их солености. Переохлаждение воды в природе, т. е. понижение ее температуры замерзания по отношению к 0°С, наблюдается очень часто. В речных условиях переохлаждение поверхностного слоя воды составляет даже порядка — 1°С. Переохлажденная на поверхности реки вода переносится в глубину турбулентным течением и в благоприятных условиях образует внутриводный (шуга) и донный лед. При этом степень переохлаждения глубинных вод значительно меньше, чем поверхностных. Переохлаждение наблюдается также в озерах и морях, где оно впервые и было обнаружено еще в XVIII в. в виде так называемого якорного льда на опущенных на дно якорях. В лабораторных условиях в капиллярных трубках дистиллированную воду удалось переохладить до температуры — 33°С. 3. Тепловые характеристики воды. Теплоемкость — это количество теплоты, поглощаемой телом при нагревании его на 1 °С. Определяется она по формуле C = dQ / dt или C = Q /Δ t, (2.12) где dQ — бесконечно малое количество теплоты, вызвавшее бесконечно малое повышение температуры dt; Δ t = t 2 - t 1 — изменение температуры тела, происходящее в результате подвода к нему количества теплоты Q; t 1 и t 2 — температура тела до и после подвода к нему теплоты. Характеристикой теплоемкости вещества принята удельная теплоемкость — отношение теплоемкости тела к его массе: c = C / m или c = Q /(m Δ t). (2.13) Удельная теплоемкость воды — это количество теплоты, необходимое для нагревания 1кг дистиллированной воды на 1°С в пределах 14,5 — 15,5°С. Удельная теплоемкость воды слабо зависит от температуры, поэтому в практических расчетах ее значение может быть принято постоянным, равным 4,2 кДж/(кг·°С). Удельная теплоемкость воды уменьшается с повышением температуры. Этим свойством, а также довольно большим значением удельной теплоемкости, вода отличается от всех других веществ, кроме ртути. С увеличением минерализации воды теплоемкость ее уменьшается. Для морской воды при малой солености теплоемкость уменьшается примерно на 0,006кДж/(кг·°С) на 1‰. Таблица 2.1
|

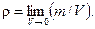
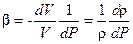
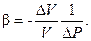 Сжимаемость характеризуется коэффициентом сжимаемости β, который равен отношению относительного изменения объема жидкости V к изменению давления P и определяется по формуле
Сжимаемость характеризуется коэффициентом сжимаемости β, который равен отношению относительного изменения объема жидкости V к изменению давления P и определяется по формуле
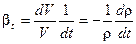 Вода, как и всякое вещество в природе, расширяется при повышении температуры и сжимается при ее понижении. Это расширение (сжатие) характеризуется коэффициентом объемного расширения, который равен отношению относительного изменения объема жидкости V к изменению температуры t и определяется по формуле
Вода, как и всякое вещество в природе, расширяется при повышении температуры и сжимается при ее понижении. Это расширение (сжатие) характеризуется коэффициентом объемного расширения, который равен отношению относительного изменения объема жидкости V к изменению температуры t и определяется по формуле
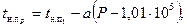
 где — температура наибольшей плотности пресной воды при давлении Р; — температура наибольшей плотности пресной воды при давлении 1,01·105 Па; а— коэффициент пропорциональности.
где — температура наибольшей плотности пресной воды при давлении Р; — температура наибольшей плотности пресной воды при давлении 1,01·105 Па; а— коэффициент пропорциональности.