Объемные методы определения урана в твердых материалах и растворах
Утверждаю Декан ФТФ _________________ Бойко В.И. «___»________________2004 г.
ОБЪЕМНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ УРАНА В ТВЕРДЫХ МАТЕРИАЛАХ И РАСТВОРАХ
Методические указания к выполнению лабораторных работ по дисциплинам «Спецхимия» для студентов специальности 240601 (250900) «Химическая технология материалов современной энергетики» и «Химия редких, рассеянных, радиоактивных элементов» для студентов специальности 240603 (251700) «Химическая технология редких элементов и материалов на их основе» по направлению 240600 (655200) «Химическая технология материалов современной энергетики».
Томск - 2004 г.
УДК 546.791: 543. 24 (07)
Объемные методы определения урана в твердых материалах и растворах Методические указания к выполнению лабораторных работ по дисциплинам «Спецхимия» для студентов специальности 240601 (250900) «Химическая технология материалов современной энергетики» и «Химия редких, рассеянных, радиоактивных элементов» для студентов специальности 240603 (251700) «Химическая технология редких элементов и материалов на их основе» по направлению 240600 (655200) «Химическая технология материалов современной энергетики».
Томск: изд. ТПУ 2004 г. – 9 с.
Составители: Маслов А.А. Водянкин А.Ю.
Рецензент: к.т.н., доцент Каляцкая Г.В.
Методические указания рассмотрены и рекомендованы методическим семинаром кафедры ХТРЭ № _______ от «____»________________2004 г.
Зав. кафедрой ХТРЭ ______________________________ И.И. Жерин I. ЦЕЛЬ РАБОТЫ
1. Освоить методику оксидиметрического определения урана. 2. Определить содержание урана в пробе раствора, в твердой навеске.
II. ХАРАКТЕРИСТИКА ОБЪЕМНЫХ МЕТОДОВ ОПРЕДЕЛЕНИЯ УРАНА
Объемные методы определения урана, получившие наибольшее распространение в аналитической практике, основаны главным образом на реакциях его восстановления и окисления. Уран в водных растворах может существовать в следующих состояниях: U(III), U(IV), U(V), U(VI), причем соединения U(III) и U(V) в водных растворах очень неустойчивы: U(III) окисляется кислородом воздуха, U(V) диспропорционирует на U(IV) и U(VI). Валентные состояния U(IV) и U(VI) достаточно устойчивые, что позволяет широко использовать окислительно-восстановительные свойства этой системы для количественных определений элемента. Редуктометрические методы, основанные на прямом титровании U(VI) растворами восстановителей, широкого практического использования не находят из-за сложности приготовления и хранения титрованных растворов восстановителей (чаще солей хрома (II) и титана (III)). В аналитической практике чаще используют оксидиметрические методы, основанные на окислении U(IV) до U(VI). Перед проведением оксидиметрического титрования U(VI) восстанавливают до U(IV). Нормальный окислительно-восстановительный потенциал для реакции:
Наиболее часто уран (VI) восстанавливают в сернокислых растворах металлами (кадмий, цинк, висмут), жидкими амальгамами цинка, кадмия и висмута, растворами солей титана (III) и хрома (II). Нормальные окислительно-восстановительные потенциалы указанных восстановителей следующие:
В качестве окислителей при титровании U(IV) в кислых растворах наиболее часто применяют перманганат и бихромат калия, соли ванадия (V), церия (IV) и железа (III). Их нормальные окислительно-восстановительные потенциалы имеют следующие величины:
III. ОПРЕДЕЛЕНИЕ УРАНА В ВОДНОМ РАСТВОРЕ
Цель работы – определение количества урана, содержащегося в растворе путем титрования раствора U(SO4)2 раствором перманганата калия. Исходное соединение урана – водный раствор нитрата уранила.
Последовательность химических операций:
1. перевод нитрата уранила в сульфат; 2. восстановление сульфата уранила цинком в сернокислой среде до сульфата урана:
3. титрование сульфата урана перманганатом калия:
Реактивы:
1. Серная кислота концентрированная, уд. вес = 1,8 г/см3; 2. цинк гранулированный; 3. 0,1 N раствор перманганата калия.
Ход работы
К полученному раствору нитрата уранила добавить 3 мл концентрированной серной кислоты и поставить на электроплитку. Выпаривать до интенсивного появления белых паров SO3. Раствор охладить, разбавить дистиллированной водой (50 мл). Воду приливать только к холодному раствору. В коническую колбу на 250 ¸ 300 мл добавить 10 ¸ 15 гранул цинка и сюда же влить раствор из фарфоровой чашки, в которой проводили отдымливание. Чашечку сполоснуть дважды дистиллированной водой по 30 мл. Промывные воды вылить в ту же коническую колбу. Колбу закрыть резиновой пробкой и поставить на механический встряхиватель. Восстановление вести не менее 25 минут. После этого раствор перелить в другую коническую колбу. Первую колбу с гранулированным цинком дважды промыть дистиллированной водой и промывные воды присоединить к основному раствору. После этого раствор урана в колбе титровать 0,1 N раствором перманганата калия до слабо-розового окрашивания всего раствора. По окончании работы написать в молекулярной форме все реакции, в которых участвует уран, и провести расчет количества урана, содержащегося в растворе по закону действующих масс на основе уравнения реакции титрования сульфата урана раствором перманганата калия. В выводе о проделанной работе указать количество урана в полученном растворе.
IV. ТИТАНО-ФЕРРОИНОВЫЙ МЕТОД ОПРЕДЕЛЕНИЯ УРАНА В ЗАКИСИ-ОКИСИ, ДИОКСИДЕ, ТЕТРАФТОРИДЕ, ДИАЦЕТАТЕ
Данный метод позволяет определить в твердой пробе четырехвалентный уран и общее количество урана, т.к. при растворении в фосфорной кислоте уран переходит в раствор, не меняя валентности:
Далее одну аликвотную часть раствора титруют бихроматом калия для определения U4+:
а в другой аликвотной части первоначально U(VI) восстанавливают титаном (III) до U(IV):
с последующим титрованием бихроматом калия. Перед титрованием избыток треххлористого титана разрушается действием соляно кислого гидроксиламина, который при комнатной температуре не окисляет уран (IV) и не мешает его титрованию бихроматом калия в присутствии ферроина в качестве индикатора.
Реактивы:
1. ортофосфорная кислота, 80 ¸ 85% - ая, уд. вес. 1,63 ¸ 1,69. 2. серная кислота, разбавленная 1: 2; 3. соляная кислота, разбавленная 1:1; 4. ферроин, 0,4% - ый водный раствор – индикатор; 5. титан треххлористый, 5% - ый раствор. Продажный препарат «15» разбавляют в 6 N HCl в отношении 1:2; 6. гидроксиламин солянокислый (NH2OH×HCl), 10% - ый водный раствор; 7. бихромат калия.
Ход анализа
Навеску анализируемого материала, содержащего уран, растворить в стакане емкостью 100 мл в 20 мл ортофосфорной кислоты при нагревании на электроплитке в течение 10¸15 минут. Полученный прозрачный раствор охлаждают до комнатной температуры и переводят в мерную колбу на 100 мл. Стакан ополаскивают серной кислотой, разбавленной 1:2, сливают в колбу и доводят до метки той же кислотой. Закрыв пробкой, тщательно перемешивают. Из мерной колбы отбирают пипеткой 25 мл раствора и переносят в коническую колбу емкостью 200¸250 мл. Точно такой же обьем раствора отбирают в другую коническую колбу. В этой колбе проводят определение общего содержания урана. Для этого предварительно уран восстанавливают до четырехвалентного путем добавления к пробе 1¸2 мл 5% - ного раствора титана треххлористого. Раствору дают постоять 5 минут, после чего добавляют 1 мл 10% - ного раствора гидроксиламина и оставляют раствор на 15 минут. В это время определяют содержание четырехвалентного урана в пробе первой колбы. К раствору в колбе добавляют 15 мл серной кислоты, разбавленной 1: 2 и 2 капли раствора ферроина. Появляется ярко-розовая окраска. Раствор титруют 0,05 N раствором бихроматом калия до перехода окраски в зеленую. Далее определяют общий уран (во второй колбе). Раствор доводят до общего объема 100 мл серной кислотой, разбавленной 1:2, прибавляют 2 капли раствора ферроина и титруют 0,05 N раствором бихромата калия. Расчет количества урана в анализируемой пробе раствора проводят по реакции титрования урана бихроматом калия. В отчете по данной работе написать в молекулярной форме все реакции, в которых участвует уран, привести расчет количества урана (IV) и урана общего. В выводе о проделанной работе указать количество урана, содержащегося в навеске исследуемого материала.
V. ФЕРРО-ФОСФАТНО-ВАНАДАТНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ УРАНА В РУДАХ, КОНЦЕНТРАТАХ
Метод включает разложение навески материала в фосфорной кислоте с добавкой окислителя, восстановление урана (VI) в фосфорнокислой среде, окисление избытка соли Мора и восстановление примеси (Fe, As, W, V, Mo, Sn, Cu, Mn и др.) нитритом натрия, избыток которого разрушается мочевиной. Уран (IV) титруют ванадатом аммония в присутствии индикатора – дифениламинсульфоната натрия.
Реакции:
Реактивы:
1. ортофосфорная кислота уд. вес 1,6; 2. перекись водорода, 30%-ный раствор; 3. соль Мора FeSO4 × (NH4)2SO4 × 6H2O, 10%-ный раствор в 0,5 N H2SO4 ; 4. мочевина (NH2)2СO, 30%-ный раствор; 5. нитрит натрия, NaNO2, 5%-ный раствор; 6. индикатор – дифениламинсульфонат натрия; 7. ванадат аммония, NH4VO3 , 0,0168 N раствор.
ход работы
Навеску 0,15 ¸ 1,0 г материала, содержащего U3O8, помещают в коническую колбу, смачивают небольшим количеством воды (2 ¸ 3 мл), заливают 15 мл фосфорной кислоты, 2 – 3 мл перекиси водорода 30%-ной. Пробу тщательно перемешивают до полного распределения материала по всему объему, умеренно нагревают до прекращения разложения перекиси водорода (прекращение бурного вскипания пробы) и кипятят после этого еще 5 – 6 мин. Колбу снимают с плитки, к раствору добавляют 2 – 3 мл 10%-ного раствора соли Мора и выдерживают не более 2 минут. Затем раствор охлаждают до 10 – 20° С, приливают 5 мл 5%-ного раствора нитрита натрия, энергично перемешивают до полного исчезновения коричневой окраски и продолжают взбалтывать еще 5 – 10 сек. Приливают 1 мл 30%-ного раствора мочевины, энергично взбалтывают до прекращения бурного выделения пузырьков газа и раствор титруют ванадатом аммония в присутствии 5 – 6 капель индикатора – дифениламинсульфоната натрия до появления фиолетовой окраски. Вычисляют содержание урана по уравнению реакции титрования урана (IV).
В отчете о проделанной работе написать в молекулярной форме все реакции, в которых участвует уран, привести расчеты и указать в выводе количество урана, содержащегося в исходной навеске материала.
VI. меры безопасности при выполнении работ
1. Работать только в халате и на отведенном для этой работы месте. 2. Строго выполнять требования инструкции по работе с радиоактивнымивеществами и с агрессивными химическими веществами. 3. Отработанные радиоактивные растворы сливать только в специально предназначенные емкости. 4. Категорически воспрещается радиоактивные растворы, концентрированные кислоты и щелочи набирать в пипетки ртом. Для этого пользоваться резиновой грушей. 5. С концентрированными кислотами и щелочами работать только в вытяжном шкафу. 6. Пользоваться электроплиткой только с закрытой спиралью.
Литература:
1. В.К. Марков, А.В. Виноградов и др. Уран, методы его определения. Издательство Госкомитета по использованию атомной энергии. – М., 1960 г. 2. Л.Л. Борин, А.И. Карелин. Термодинамика окислительно- восстановительных процессов в технологии актинидов. – М.: Атомиздат, 1977 г.
Подписано к печати «____»______________2004 г. Формат Бумага Плоская печать. Усл. печ. л. уч.- изд. л Тираж экз. Заказ______ Бесплатно. ТПУ, 634034. г. Томск, пр. Ленина, 30.
|

 E0 = 0,334 в.
E0 = 0,334 в. E0 = 0, 00 в.
E0 = 0, 00 в. E0 = 0, 1 в.
E0 = 0, 1 в. E0 = - 0, 41 в.
E0 = - 0, 41 в.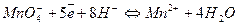 Е0=1,51 в.
Е0=1,51 в.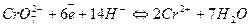 Е0=1,33 в.
Е0=1,33 в. Е0=1,004 в.
Е0=1,004 в. Е0=1,61 в.
Е0=1,61 в. Е0=0,77 в.
Е0=0,77 в. .
.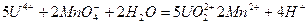 .
. .
. ,
,
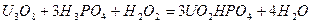 ;
; ;
;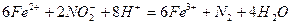 ;
;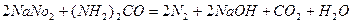 ;
; .
.


