Раствор, содержащий 1 моль эквивалентов вещества Х в 1 л, называют нормальным раствором этого вещества.
Вместо обозначения единицы измерения моль/л допускается сокращение «н». Например, 1 н H2SO4, т.е. 1 моль ½ молекулы H2SO4. При использовании молярной концентрации эквивалента следует указывать конкретную реакцию, в которой данный нормальный раствор применяется или приводить фактор эквивалентности. Например, с (½ H2SO4) =1 н (в кислотно-основной реакции) или 1 н H2SO4 fэ кв(H2SO4) = ½. Термин «нормальность» не рекомендуется. Если fэ кв(Х) = 1,предпочтительней использовать термин «молярный» раствор вместо «нормальный» раствор, так как никаких преимуществ нормальный раствор в этом случае не имеет.
1.3.1. Расчет результата прямого титрования при разном способе выражения концентрации раствора Если известны молярная концентрация щелочи с (NaOH) и объем раствора V (NaOH), израсходованный на титрование кислоты, то количество вещества щелочи, затраченное на реакцию, будет равно: n (NaOH) = В точке эквивалентности количество вещества щелочи, израсходованное на реакцию, будет точно равно количеству вещества кислоты в анализируемом растворе: n (NaOH) = n (HCl). (2) Подставляем уравнение (2) в (1)
Количество вещества эквивалента кислоты, находящееся в анализируемом растворе, можно также n (HCl) = При подстановке уравнения (4) в (3)получается очень важное уравнение c (NaOH) · V (NaOH) = c (HCl) V(HCl) (5) Если известен объем анализируемого раствора, по уравнению (5) можно рассчитать его концентрацию. Масса m (HCl) в анализируемом растворе рассчитывается по соотношению m (HCl) = n (HCl) M(HCl) = где M (HCl) – молярная масса эквивалента HCl. Если, например, с (NaOH) = 0,1048 моль / л, V(NaOH) = 22,52 мл, то M (HCl) = Уравнение (6) можно использовать для оценки погрешности прямого титриметрического анализа. Относительная погрешность результата, вычисленного по уравнению (6), будет равна
При работе с 0,1 н растворами абсолютная погрешность установления молярной концентрации эквивалента (S c) не превышает ± 0,0002, погрешность измерения объема титранта (S V) по обычной бюретке составляет не более ± 0,03 мл, а погрешность в величине молярной массы эквивалента (S M) пренебрежимо мала. Подставляя численные значения в уравнение (7), получаем
Если титруется не весь раствор кислоты, а аликвота, результат анализа рассчитывают по уравнению m(HCl) = где V k и V n – объем мерной колбы и пипетки соответственно. Погрешность результата вычисляют по уравнению
Погрешность в определении объема мерной колбы на 100,0 мл обычно составляет ± 0,05 мл, а пипетки ±0,03 мл. Подстановка численных значений в уравнение (8) дает
или 0,27 %. Как видно, основной вклад в погрешность анализа вносит погрешность в определении концентрации титранта. Раствор в титриметрическом анализе нередко характеризуют молярной концентрацией эквивалента с поправочным коэффициентом. Поправочный коэффициент равен отношению истинной молярной концентрации эквивалента с ист рабочего раствора к округленной табличной молярной концентрации эквивалента с табл, для которой можно заранее рассчитать, какой массе определяемого вещества соответствует 1 мл рабочего раствора. Так, например, 22,50 мл точно 0,1000 М NaOH нейтрализуют 0,08204 г HCl, а 22,52 мл этой щелочи - 0,08211 г HCl и т.д. Если истинная молярная концентрация эквивалента с ист = 0, 1048 моль/л, то поправочный коэффициент равен К= При расчете результатов титрования табличный результат умножают на поправочный коэффициент. Если израсходовано 22,52 мл кислоты, табличный результат равен 0,08211 г и истинная масса кислоты составит m (HCl)= m таблК = 0,08211· 1,048 = 0,08605 г. Этот способ очень удобен при серийных определениях и широко используется в цеховых и заводских лабораториях. Если известен титр раствора (Т), т.е. масса (г) растворенного вещества в 1 мл раствора, то количество вещества эквивалента щелочи, вступившее в реакцию, составит n (NaOH)= Тогда масса в анализируемом растворе будет равна:
Способ громоздкий и менее удобный по сравнению со способом молярных концентраций эквивалента. Широко распространен в практике способ расчета результатов анализа с помощью условного титра рабочего раствора или титра раствора по определяемому веществу. Он показывает массу определяемого вещества, которая соответствует 1 мл рабочего раствора. В данном примере 1 мл 0,1048 н. NaOH соответствует 0,003821 г HCl, т. е. T(NaOH/HCl) = 0,003821 г/мл. Тогда результат анализа: m (HCl) = T(NaOH/HCl)· V (NaOH) = 0,003821·22,52 = 0,08605 г HCl (9)
Чтобы найти связь между разными способами выражения концентраций, приравниваем массу определяемого вещества, рассчитанную при использовании разных способов. Пусть, например, известна молярная концентрация эквивалента NaOH, требуется рассчитать T(NaOH/HCl). Приравниваем правые части уравнения (6) и (9):
отсюда
Совершенно аналогично рассчитывается результат при титровании по методу замещения.
1.3.2. Расчет результата в методах обратного титрования Рассмотрим расчет результата на примере обратного титрования хлорида. В этом методе к анализируемому раствору хлорида добавляется заведомый избыток титрованного раствора AgNO3 , и не вступившее в реакцию с хлоридом количество вещества AgNO3 оттитровывается раствором NH4SCN. Если n (AgNO3) – количество вещества AgNO3, добавленное к анализируемому раствору хлорида, n (AgCl) – количество вещества эквивалента AgNO3, израсходованное на реакцию с хлоридом, а n (AgSCN) на реакцию с тиоцианатом, то, очевидно, n (AgNO3) = n (AgCl) + n (AgSCN). (10) Величина n (AgNO3) определяется молярной концентрацией эквивалента основного рабочего раствора AgNO3 и его объемом
n (AgNO3) = Молярная концентрация эквивалента вспомогательного раствора NH4SCN и его объем, затраченный на реакцию с избытком AgNO3 после охлаждения хлорида, точно известны, поэтому
Количество вещества - эквивалента хлорида в анализируемом растворе находим из уравнения (10) n (AgCl) = n (AgNO3) – n (AgSCN)
и подставляем в это соотношение уравнения (11) и (12) n = (AgCl) Масса хлорида в анализируемом растворе будет равна:
m(Cl) = n(AgCl) M(Cl) =
Результат обратного титрования всегда рассчитывается по разности между взятым количеством вещества - эквивалента основного рабочего вещества и оставшимся после его реакции с определяемым компонентом. Погрешность методов обратного титрования можно рассчитать также с помощью формулы
причем для упрощения ориентировочных расчетов примем, что концентрация обоих рабочих растворов одинакова. Тогда уравнение (13) переходит в
где c = c (AgNO3) = c (NH4SCN), а Δ V = V 1 -V 2, если V 1 = V (AgNO3), V 2 =V(NH4SCN). Применим к уравнению (14) формулу (13а):
Погрешность определения молярной концентрации эквивалента Sc в уравнении (15) будет зависеть от погрешностей, с которыми определены концентрации каждого из раствора, и по закону сложения ошибок
где S1 и S2 – погрешности определения молярной концентрации эквивалента растворов AgNO3 и NH4SCN соответственно. Погрешность разности объемов SΔv по закону сложения ошибок будет равна:
где SV1 и SV2 –погрешности определения объемов AgNO3 и NH4SCN соответственно. При подстановке уравнений (16) и (17) в (15) получаем
Если считать, что при работе 0,1 н растворами погрешности в определении молярной концентрации эквивалента составляет ± 0,0002, а объемы рабочих растворов определяются с погрешностью ± 0,02 мл, подстановка численных значений в уравнение (18) дает
Из уравнения (19) видно, что погрешность анализа в значительной степени зависит от разности объемов рабочих растворов, использованных при титровании: с увеличением разности погрешность уменьшается. Расчет по уравнению (19) показал, что при Δ V =1,0 мл относительная погрешность анализа составляет 2,8%, при Δ V = 5,0 мл она уменьшается до 0,63%, а при Δ V = 25,0 мл – до 0,32%. Очевидно, при обратном титровании разность объемов 0,1н рабочих растворов менее10,0 мл нежелательна в связи с большой погрешностью анализа. Приведенные расчеты носят, разумеется, ориентировочный характер, так как связаны с некоторыми допущениями, и заключительная рекомендация о предельной величине ΔV=10,0 мл абсолютного значения не имеет, но окончательный вывод об увеличении погрешности анализа с уменьшением разности объемов рабочих растворов останется справедливым в любом случае.
1.4. Кривые титрования Важной характеристикой титриметрических методов являются кривые титрования. Они показывают графическую зависимость концентрации участника реакции, протекающей при титровании (или логарифма концентрации, или какого-то свойства или характеристик раствора), и от объема добавленного титранта (или от степени оттитрованности). Например, для реакций кислотно-основного взаимодействия такой характеристикой раствора является его рН. Различают рассчитанные теоретические и экспериментальные кривые титрования. Теоретический расчет кривых титрования обычно проводится по данным о константе равновесия реакции, протекающей при титровании, и исходным концентрациям реагирующих веществ. Если нормальные концентрации титруемого раствора и титранта одинаковы и для титрования взяли 100,0 мл раствора, то число миллилитров добавленного титранта будет равно степени протекания реакции между титрантом и определяемым веществом (степени оттитрованности). Такие кривые служат главным образом для обоснованного выбора индикатора в данном титровании, который обеспечил бы необходимую точность определения. Экспериментальные кривые титрования получают, измеряя какое-либо свойство системы в ходе титрования (оптическую плотность, диффузионный ток и т.д.) в зависимости от объема добавленного титранта и строят соответствующий график. Такие кривые служат для определения точки эквивалентности.
1.5. Основные методы титриметрического анализа В титриметрическом анализе используют реакции различного типа: - кислотно-основного взаимодействия, комплексообразования и т.д., удовлетворяющие тем требованиям, которые предъявляются к титриметрическим реакциям. Отдельные титриметрические методы получили название по типу основной реакции, протекающей при титровании или по названию титранта (например, в аргентометрических методах титрантом являются раствор AgNO3, в перманганатометрических – расвор KMnO4 и т. д.). По способу фиксирования точки эквивалентности выделяют методы титрования с цветными индикаторами, методы потенциометрического титрования, кондуктометрического, фотометрического и т.д. При классификации по типу основной реакции, протекающей при титровании, обычно выделяют следующие методы титриметрического анализа: 1. Методы кислотно-основного взаимодействия – они связаны с процессом передачи протона Н++ОН- = Н2О СН3СООН+ ОН- = СН3СОО- + Н2О СО32- + Н+ = НСО3- 2. Методы комплексообразования – они основаны на реакциях образования координационных соединений Hg2+ + 2Cl- = HgCl2 (меркуриметрия) Mg2+ + H2Y2- = MgY2- + 2H+ (комплексонометрия)
3. Методы осаждения – они основаны на реакциях малорастворимых соединений Ag+ + Cl- =AgCl (аргентометрия) Hg22+ + 2Cl- = Hg2Cl2 (меркурометрия)
4. Методы окисления – восстановления – они объединяют многочисленную группу окислительно-восстановительных реакций: MnO-4 + 5 Fe2+ + 8H+ = Mn2+ + 5 Fe3+ + 4H2O (перманганатометрия) 2S2O32- + I2 = S4O62- + 2I- (йодометрия)
Аналитическая характеристика каждого метода включает наиболее существенные его особенности: приготовление и свойства рабочих растворов, виды кривых титрования, погрешности определения, способы индикации точки эквивалентности и практического применения.
1.6. Порядок титрования Правильное определение конечной точки титрования зависит не только от выбора индикатора, но и от принятого в работе порядка титрования. По методу нейтрализации титрование выполняют «от кислоты к щелочи», т.е. приливанием к кислоте щелочи из бюретки или, наоборот, от «щелочи к кислоте». При этом выбор индикатора не безразличен. Например, если, титруя «от кислоты к щелочи», воспользоваться метиловым оранжевым (или метиловым красным), то розовая окраска индикатора от избыточной капли щелочи должна перейти в желтую. Но такое изменение окраски гораздо хуже улавливается глазом, чем переход ее из желтой в розовую. Поэтому с метиловым оранжевым (или метиловым красным) титруют «от щелочи к кислоте». С фенолфталеином удобнее титровать «от кислоты к щелочи», так как при этом бесцветный раствор становится малиновым. Иногда для лучшего определения конечной точки титруют с так называемым «свидетелем». В запасную коническую колбу (или стакан) наливают дистиллированную воду в количестве приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде столько же капель индикатора, в данном случае метилового оранжевого, сколько их будет взято для титрования, и приливают из бюретки 1-2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный таким образом «свидетель» используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и «свидетеля» была одинакова. С помощью «свидетеля» вводят также поправку в результаты титрования на прибавленный избыток кислоты, т.е. из затраченного объема ее вычитают объем двух капель (~ 0,06 мл), пошедших на окрашивание индикатора в «свидетеле». Наконец, правильное определение конечной точки титрования зависит от количества прибавленного индикатора. Иногда стараются прилить больше индикатора, полагая, что большая интенсивность окраски раствора облегчит определение конечной точки титрования. Но чем больше прибавляется индикатора, тем труднее заметить изменение окраски, так как оно будет происходить медленнее. Для установления точки эквивалентности имеет значение не столько яркость окраски раствора, сколько четкость ее изменения. Опытным путем найдено, что на 10-15 мл анализируемого раствора следует брать одну каплю индикатора, а на 25 мл – не более двух капель. Таким образом, результат титриметрического определения зависит не только от выбора индикатора, но также от взятого количества его и от принятого порядка титрования.
Раздел 2. Кислотно-основное титрование (метод нейтрализации) В основе метода лежит протолитическая реакция H3O+ + OH- → 2H2O. Этим методом проводят количественное определение щелочей, кислот, определение некоторых солей, имеющих подобно Na2CO3 и Na2B4O7, сильнощелочную реакцию вследствие гидролиза и поэтому титрующихся кислотами, определение жесткости воды, солей аммония, определение азота в органических соединениях и т.д. Основными рабочими растворами в этом методе являются раствор кислоты (обычно HCl и HSO4) и раствор щелочи (NaOH или KOH). В качестве стандартных веществ при установке титров кислот чаще всего применяют тетраборат натрия (буру) Na2B4O7·10Н2О или безводный карбонат натрия. Для установки титра щелочей чаще пользуются щавеливой кислотой Н2С2О4· 2Н2О или янтарной кислотой H2C4H4O4.
2.1. Приготовление и стандартизация раствора соляной кислоты
|

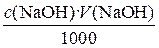 (1)
(1) представить соотношением
представить соотношением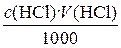 . (4)
. (4)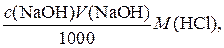 (6)
(6) г.
г. (7)
(7)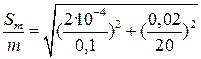 = 2,2 ·10-3, или 0,22 %.
= 2,2 ·10-3, или 0,22 %.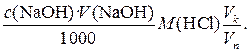
 (8)
(8)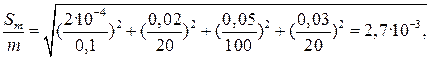

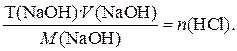
 г.
г.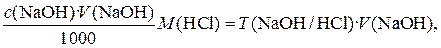

 (11)
(11) (12)
(12)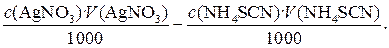
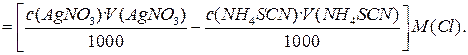 (13)
(13)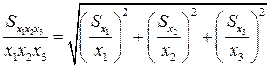 (13а)
(13а)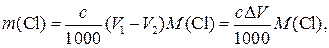 (14)
(14) (15)
(15) будет равна
будет равна (16)
(16)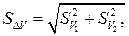 (17)
(17)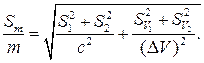 (18)
(18) (19)
(19)


