Величины ∆G , ∆F, ∆μ (и все их вариации), характеризующие меру отклонения системы от равновесия, называются движущей силой кристаллизации.
На практике за движущую силу кристаллизации чаще принимают не энергетические величины из-за трудностей учета взаимодействия частиц друг с другом (системы идеальны): пересыщение, переохлаждение. Пересыщение выражают через абсолютное:
α = ∆с = с – с0 (1.17) и относительное:
а также через коэффициент, или степень пересыщения:
Раствор пересыщен, если γ > 0, и недосыщен, если γ < 1. Для расплавов значения с и с0 заменяются Т и Т0, для паров – р и р0. Наличие движущей силы кристаллизации еще не определяет направление процесса, кристаллизация может не состояться.
Таким образом, метастабильное – это относительно устойчивое состояние пересыщенных растворов (переохлажденных расплавов и т.д.), которое теряет устойчивость при внешнем воздействии, при затрате определенной работы, которую Гиббс называет мерой устойчивости метастабильной системы. Эту работу можно выполнить и вне системы и результат ее ввести в систему в виде готового зародыша новой фазы величины, не меньшей критической (позволяющей ему оставаться в равновесии со средой). Тогда кристаллизация на поверхности этого зародыша совершается самопроизвольно, т.е. с уменьшением свободной энергии (∆G < 0). Из рассмотренного следует, что кристаллизация в метастабильной системе состоит из двух стадий: вынужденной стадии зародышеобразования – стадии образования поверхности раздела фаз и второй самопроизвольной стадии – роста на затравке . Стадия зародышеобразования вынужденная потому, что при возникновении поверхности раздела кристалл – среда возрастает изобарно-изотермический потенциал системы (∆G > 0),увеличивается ее свободная энергия на величину, зависящую от размера поверхности и ее поверхностной энергии σ;. Целеустремленное выращивание монокристалла возможно в метастабильных системах в присутствии затравочного кристалла и при наличии направленного теплоотвода. В связи с этим необходимо четкое представление о величине предельного пересыщения растворов и паров, переохлаждения расплавов.
3) Вывод уравнения Томсона.
Возможность существования метастабильных систем связана с зависимостью растворимости (упругости пара и температуры плавления) от размера частиц. Пар, раствор или расплав, находящийся в равновесии с крупными кристаллами, оказывается ненасыщенным (перегретым) в отношении мелких. Увеличение дисперсности способствует плавлению – температура плавления мелких кристаллов размером в сотни ангстрем всегда ниже, чем у кристаллов обычных размеров. Точно так же мелкие кристаллы обладают большей растворимостью, чем крупные. В случае конденсации паров В. Томсон нашел для каждой степени пересыщения паров определенный размер капель жидкости, остающихся в равновесии с пересыщенным паром:
где σ – поверхностное натяжение; М - молекулярный вес; r – радиус жидкой капли (велик по сравнению с радиусом действия молекулярных сил); ρ; - плотность жидкости. Вывод уравнения Томсона почти стандартен. Две капли одной и той же жидкости с радиусами r1 и r2 находятся в изолированных сосудах: каждая окружена собственным паром, упругости которого соответственно равны р(r1) и р(r2). Совершаются две работы изотермического кругового процесса А1 и А2. Работа dА1 перегонки элементарной массы жидкости dm из большей капли с радиусом r1 в меньшую с r2 равна:
Имеющая обратный знак работа по механическому переносу dm массы жидкости из капли r2 в каплю и r1 , приводящая к изменению поверхностной энергии последней, равна dА2. При этом приращение объема капли можно выразить через
Уменьшение поверхности капли r2 равно:
Так как после кругового процесса все пришло в исходное состояние, то:
После сокращения получаем:
или
где Уравнение Томсона в виде, отличном от (1.20):
Можно выразить графически (рис. 1.2). Мелкие капли, обладая большим давлением паров, постепенно будут самопроизвольно перегоняться в более крупные (и на плоскую поверхность жидкости).
20 °С. Металлы характеризуются сравнительно малым протяжением метастабильной области. Достаточно очевидно, что метастабильная область тем шире, чем больше относительная молекулярная масса растворенного вещества. Опыт показывает, что способность к переохлаждению жидкостей, содержащих ионы, возрастает при увеличении заряда ионов и при уменьшении их радиусов. В органических веществах переохлаждению способствуют ОН-группы. Возникновение кристаллов, как и любой фазовый переход, значительно легче осуществляется на примесях. Если систему особенно тщательно очистить от примесей, то, будучи в большой мере переохлажденной, она теряет способность к кристаллизации. Многочисленные опыты по выдержке переохлажденных, предварительно перегретых, тщательно очищенных и помещенных в герметически закрытые сосуды жидкостей показывают, как далеко влево сдвигается верхняя граница метастабильной области А′В′;.
4) Диаграммы состояния и равновесный коэффициент распределения.
Фазовые превращения удобно представлять графически. Анализ диаграммы состояния предваряет все работы по выращиванию кристаллов. Диаграммы состояния применимы только к системам в состоянии равновесия. На рис. 1.3 представлены диаграммы состояния двойных систем, в которых переменными служат состав, температура и давление. Вдоль линии равновесия систему определяет задание одной переменной. На рис. 1.3 (а) показаны фазовые соотношения, типичные для изоморфных соединений – компоненты А и В полностью растворимы друг в друге как в твердом, так и в жидком состояниях. Кривая ликвидуса дает температуру затвердевания расплава в зависимости от состава, тогда как кривая солидуса характеризует температуру, при которой начинается в зависимости от состава плавление твердой фазы. Горизонтали (1 – 2 и др.) связывают жидкости и твердую фазу одного состава, находящиеся в равновесии.
На рис. 1.3 (б) А и В не полностью смешиваются друг с другом в твердом состоянии. От чистого А до точки 2 фазой является твердый раствор В в А. Ликвидус 1 – 2 и солидус 1 – 3 сохраняют те же значения, что и в предыдущем случае. Между точкой 2 и чистой компонентой В раствор А устойчив в В. Солидусом и ликвидусом соответственно будут линии 4 – 5 и 2 – 5. Линия 3 – 6 характеризует растворимость В в твердой компоненте А, а ниже этой линии компонента В выпадает в твердом состоянии из твердого же раствора. Эвтектическая точка 2 характеризует температуру и состав, при которых обе компоненты А и В одновременно находятся в равновесии с расплавом. На рис. 1.3 (в) отражено фазовое соотношение, когда область твердых растворов настолько узка, что линия ликвидуса сливается с линией солидуса. На рис. 1.3 (г) показаны фазовые соотношения, для которых характерно образование соединения АВ, и систему А – В можно представить как совокупность двух подсистем А – АВ и АВ – В, в которых возможно образование эвтектик. Каждая из этих подсистем подобна системе на рис. 1.3 (б). В некоторых случаях температура плавления соединения АВ превышает температуры плавления обеих компонент А и В. На рис. 1.3 (г) соединение АВ плавится конгруэнтно, это означает, что твердая фаза АВ находится в равновесии с расплавом одинакового состава. На рис. 1.3 (д) показано инконгруэнтное плавление соединения АВ. Оно плавится при температуре Т1 – инвариантной точке, состав которой характеризует перитектику. Соединение АВ кристаллизуется в области 1 – 2 из расплава, который богаче состава АВ компонентой А. Данная диаграмма предполагает отсутствие твердого раствора. В случае образования твердого раствора диаграмма 1.3 (д) станет аналогичной 1.3 (б) и 1.3 (г). Фазовые диаграммы бинарных систем используются для определения равновесного коэффициента распределения одной из компонент между твердой и жидкой фазами. Коэффициент этот постоянен при данной температуре. Отношение массового содержания компоненты (скажем, В) в твердой и жидкой фазах
называется коэффициентом распределения или захвата примеси (компоненты В). Коэффициент К зависит от природы примеси и основного вещества. Если примесь растворяется больше, чем основное вещество, то К < 1, в противном случае К > 1. Порядок величины К изменяется от значений менее 10-3 до более 101,5. Наблюдающиеся отклонения от этого правила связываются обычно с неодинаковым изменением растворимостей примеси и основного вещества, например при скачках температуры раствора или его рН, с возникновением недиссоциирующих соединений, комплексов, изменяющих состав раствора и т.п.
На рис. 1.4 показана часть диаграммы состояния бинарной системы А – В, в которой в металл А входит компонента В, понижающая точку плавления. Концентрация примеси В в затвердевшей части будет меньше, чем в жидкости (К < 1). В равновесных условиях составу расплава, определяемому линией ликвидуса, отвечает состав твердой фазы, характеризующийся линией солидуса. Так, при затвердевании расплава состава с0 (точка Q) образуется твердая фаза состава Р, равного Кс0. По мере продвижения вправо происходит обогащение компонентой В. Предельный случай отвечает составу жидкой фазы R = c0 / K. Диаграмма, изображенная на рис. 1.5, характерна для растворов с К > 1. Здесь обогащение примесью происходит в противоположном направлении, в затвердевшей части концентрация примесей больше, чем в жидкой.
Лекция 2. Кинетика кристаллизации.
1) Кинетика кристаллизации.
Движущая сила кристаллизации сама по себе, как уже отмечалось, не определяет направленность и тем более скорость процесса. Кинетика кристаллизации определяется, с одной стороны, тепло- и массообменом со средой кристаллизации, с другой – молекулярно-кинетическими процессами на границе кристалл – среда (поверхностными процессами). Массоподача к поверхности кристалла осуществляется путем диффузии, конвекции и потока (принудительное движение). Диффузия атомов медленнее диффузии тепла. Скорость этой стадии кристаллизации зависит, в частности, от «силы сопротивления». Сейчас преобладает точка зрения на жидкость как на конденсированную фазу, близкую к кристаллу, с прочностью сил сцепления между частицами, немногим уступающей кристаллу, и с атомными расстояниями, также мало отличающимися от твердых тел. Ближний порядок в частицах жидкостей почти таков же, как и в твердых телах. Но между строением жидкой и твердой фаз не существует постепенного перехода, он осуществляется скачком. Для того чтобы совершить такой скачок в результате диффузии из раствора на кристалл, частица должна разорвать часть своих связей с соседними частицами. Для преодоления такого барьера нужна энергия активации (рис. 1.6). Вообще теплота активации Е3 – Е1 может быть определена из данных по скоростям роста при разных температурах. Преодоление барьера возможно за счет отклонения (флуктуации) энергии, концентрации и других параметров системы от среднего в ее отдельных микроскопических участках. Благодаря флуктуациям некоторые частицы временно приобретают энергию, достаточную для преодоления активационного барьера. С повышением температуры увеличивается не только средняя энергия частиц, но и размеры и частота возникновения флуктуаций, ускоряется, в частности, диффузионный перенос вещества.
Между кристаллом и окружающей его средой должен существовать переходный адсорбированный слой толщиной в несколько молекулярных слоев, который служит посредником при взаимодействии фаз. При фазовых превращениях все атомы или молекулы, переходящие их одной фазы в другую, некоторое время находятся в этом слое. Микропроцессы, протекающие в переходном слое и в совокупности определяющие кинетику роста (растворения ), называются поверхностными, или элементарными, процессами. Поверхностная кинетика определяется структурой поверхности растущего кристалла, последняя же зависит от природы этой поверхности и величины движущей силы кристаллизации. Рост кристаллов определяется несколькими процессами. Сначала кристаллизующееся вещество, «гонимое» разностью химических потенциалов μС > μК, диффундирует из среды к поверхности кристалла (объемная диффузия), затем происходит извлечение частиц из среды адсорбированным слоем, прилегающим к поверхности и, наконец, встраивание этих частиц в кристаллическую структуру; лимитирующими кинетику кристаллизации всегда будут наиболее медленные процессы.
2) Кристаллизационные среды и их особенности.
Химизм и строение среды кристаллизации наряду с кристаллической структурой определяют облик и совершенство кристалла. Более того, нужные скорости и совершенство растущего кристалла гораздо чаще достигаются в результате тщательного контроля за средой, в которой растет кристалл независимо от механизма роста.
|

 (1.18),
(1.18), (1.19)
(1.19) Рассмотрим простейшую фазовую диаграмму с = f(t) (рис. 1.1). Напомним, что концентрация насыщенного раствора численно определяет растворимость вещества при данных условиях. Все поле концентраций с – температур t распадается на три области. Стабильной области ниже кривой растворимости АВ соответствуют ненасыщенные растворы, которые могут оставаться однофазными неопределенно долгое время. В них кристаллы растворяются. Кристаллы же, введенные в раствор, отвечающий, например, точке Д могут неопределенно долго оставаться без изменения. Это состояние определяется как подвижное равновесие, когда скорости роста и растворения кристалла одинаковы. В метастабильной области теоретически возможное начало кристаллизации практически никогда не наблюдается. Все же кристалл, помещенный в раствор с «фигуративной» точкой в метастабильной области, будет расти. Чем дальше точка Д раствора от кривой насыщения, тем более устойчив кристалл. По достижении кривой А′В′;, за которой простирается лабильная область, достаточно малейшего «толчка» для начала бурной кристаллизации.
Рассмотрим простейшую фазовую диаграмму с = f(t) (рис. 1.1). Напомним, что концентрация насыщенного раствора численно определяет растворимость вещества при данных условиях. Все поле концентраций с – температур t распадается на три области. Стабильной области ниже кривой растворимости АВ соответствуют ненасыщенные растворы, которые могут оставаться однофазными неопределенно долгое время. В них кристаллы растворяются. Кристаллы же, введенные в раствор, отвечающий, например, точке Д могут неопределенно долго оставаться без изменения. Это состояние определяется как подвижное равновесие, когда скорости роста и растворения кристалла одинаковы. В метастабильной области теоретически возможное начало кристаллизации практически никогда не наблюдается. Все же кристалл, помещенный в раствор с «фигуративной» точкой в метастабильной области, будет расти. Чем дальше точка Д раствора от кривой насыщения, тем более устойчив кристалл. По достижении кривой А′В′;, за которой простирается лабильная область, достаточно малейшего «толчка» для начала бурной кристаллизации.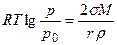 (1.20)
(1.20)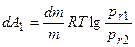
 , откуда
, откуда  , так как
, так как 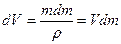 . Изменение поверхности каждой капли равно:
. Изменение поверхности каждой капли равно: .
.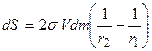 .
.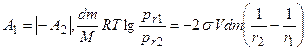 .
.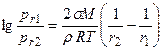

 - давление паров над бесконечно большой каплей жидкости (давление насыщенных паров);
- давление паров над бесконечно большой каплей жидкости (давление насыщенных паров);  - давление паров над каплей конечных размеров;
- давление паров над каплей конечных размеров; 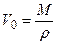 V0 – одной грамм-молекулы.
V0 – одной грамм-молекулы.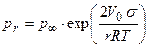
 Протяженность метастабильной области зависит от химизма и строения системы, а также от степени загрязненности, механического воздействия, скорости охлаждения и других причин. Для получения переохлажденных жидкостей нужна большая скорость переохлаждения. Во время перемешивания максимально возможное переохлаждение воды, при котором еще не наступает самопроизвольная кристаллизация, не превышает 0,4 – 0,5 °С; вода в спокойном состоянии может быть переохлаждена до – 30 °С. Многие органические вещества (тимол, салол и др.) допускают переохлаждение более чем на
Протяженность метастабильной области зависит от химизма и строения системы, а также от степени загрязненности, механического воздействия, скорости охлаждения и других причин. Для получения переохлажденных жидкостей нужна большая скорость переохлаждения. Во время перемешивания максимально возможное переохлаждение воды, при котором еще не наступает самопроизвольная кристаллизация, не превышает 0,4 – 0,5 °С; вода в спокойном состоянии может быть переохлаждена до – 30 °С. Многие органические вещества (тимол, салол и др.) допускают переохлаждение более чем на

 (1.21)
(1.21)

 При флуктуации концентраций уже в насыщенных растворах возникают комплексы сотнями ионов или молекул, расположение которых отвечает расположению в соответствующей кристаллической фазе. В пересыщенном метастабильном растворе количество и объем таких комплексов возрастают. Но, не достигнув критических размеров, эти трехмерные агрегаты частиц, «дозародыши», вновь распадаются под действием флуктуаций противоположного знака. В области лабильных растворов флуктуационным путем возникают зародыши и выше критических размеров и на них идет отложение новых частиц.
При флуктуации концентраций уже в насыщенных растворах возникают комплексы сотнями ионов или молекул, расположение которых отвечает расположению в соответствующей кристаллической фазе. В пересыщенном метастабильном растворе количество и объем таких комплексов возрастают. Но, не достигнув критических размеров, эти трехмерные агрегаты частиц, «дозародыши», вновь распадаются под действием флуктуаций противоположного знака. В области лабильных растворов флуктуационным путем возникают зародыши и выше критических размеров и на них идет отложение новых частиц.


