ИНТРАЦЕРЕБРАЛЬНЫЙ ГОМЕОСТАЗ
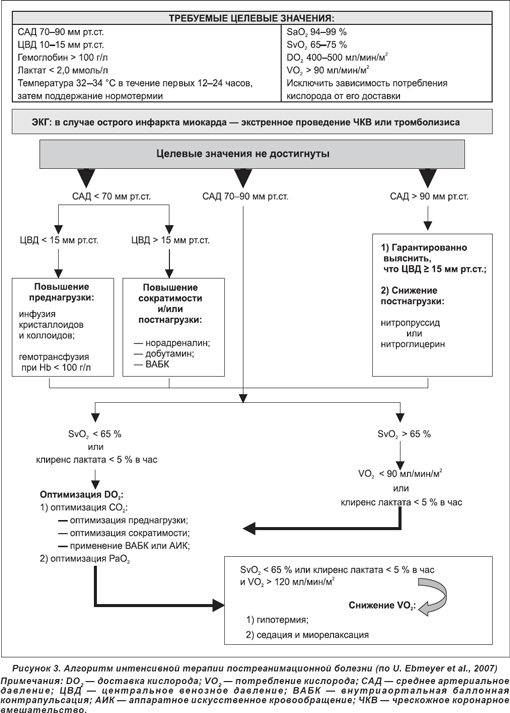
1. Фармакологические методы. На данный момент отсутствуют, с точки зрения доказательной медицины, эффективные и безопасные методы фармакологического воздействия на головной мозг в постреанимационном периоде. Проведенные на нашей кафедре исследования позволили установить целесообразность применения перфторана в постреанимационном периоде. Перфторан уменьшает отек головного мозга, выраженность постреанимационной энцефалопатии и повышает активность коры мозга и подкорковых структур, способствуя быстрому выходу из коматозного состояния. Перфторан рекомендуется вводить внутривенно в первые 6 часов постреанимационного периода в дозе 5–7 мл/кг [6]. 2. Физические методы. В настоящее время гипотермия является наиболее многообещающим методом нейропротекторной защиты головного мозга. Повторное рождение терапевтической гипотермии (ТГ) связано с открытием в 1987 г. П. Сафаром и соавт. нейропротекторного эффекта мягкой гипотермии, которая является более безопасной, нежели умеренная гипотермия, использование которой лимитировалось рядом побочных эффектов (аритмогенность, коагулопатия, инфекции легких и пр.). Точками приложения терапевтической гипотермии при ПРБ является целый ряд патофизиологических сдвигов в организме. Так, тяжесть ишемического повреждения в постреанимационном периоде увеличивается при повышении температуры тела на 0,5 °С или более 37 °С. При этом скорость образования свободных радикалов и реализация глутаматного каскада прямо пропорциональны уровню температуры в зоне ишемии. Гипертермия активирует NMDA-рецепторы, которые увеличивают уровень внутриклеточного Са2+, эффект свободнорадикального повреждения при индуцировании активации арахидоновой кислоты. Начальное нейрональное повреждение после ишемии и реперфузии является триггерным механизмом последующей хронической воспалительной реакции, реализуемой клетками микроглии, которая вызывает прогрессирующую нейродегенерацию. Терапевтический эффект гипотермии обеспечивается реализацией следующих механизмов: — сохранение пула АТФ и улучшение утилизации глюкозы тканью мозга; — ингибирование деструктивных энзиматических реакций (на 1,5 % при снижении на 1 °С температуры тела); — супрессия свободнорадикальных реакций и ингибирования аккумуляции продуктов липидной пероксидации; — уменьшение внутриклеточной мобилизации Са2+; — протекция пластичности липопротеинов цитоплазматических мембран; — снижение потребления О2 в регионах головного мозга с низким кровотоком; — снижение внутриклеточного лактат-ацидоза; — ингибирование биосинтеза и продукции эксайтотоксичных нейротрансмиттеров; — снижение нейтрофильной миграции в зонах ишемии; — снижение риска развития цитотоксического и вазогенного отека головного мозга [9, 10, 17]. Выявлено, что снижение температуры тела на 1 °С в среднем уменьшает скорость церебрального метаболизма на 6–7 % [11]. Обеспечивается улучшение доставки О2 в ишемические зоны головного мозга, а также снижение внутричерепного давления. Необходимо отметить, что в здоровом головном мозге применение анестетиков, вызывающих молчание электроэнцефалограммы, снижает скорость церебрального потребления О2 (CMRO2) только на 50 % за счет блокирования активного метаболизма. В то же время гипотермия уменьшает CMRO2 практически до нуля путем снижения базального метаболизма головного мозга. В частности, CMRO2 снижается на 7 % на каждый градус в диапазоне температур 38–28 °С, ингибируя активный метаболизм, при 28 °С — до 50 %, а при 18 °С — до 10 % (подавление базального метаболизма). При проведении клинических исследований терапевтической гипотермии был выявлен ряд побочных эффектов: — повышение вязкости крови (так, снижение температуры на 1 °С повышает гематокрит на 2 %); — холодовой диурез (однако без нарушения функции почек); — гипокалиемия; — тромбоцитопения; — пневмония; — дрожь, повышение мышечного тонуса (что приводит к повышению потребления O2 тканями); — снижение чувствительности к катехоламинам [9]. В 1997 г. S.A. Bernard et al. применили ТГ у больных с внегоспитальной остановкой кровообращения. ТГ (33 °С) была индуцирована у 22 больных в течение 12 ч наружным методом, в сравнении с группой нормотермии получено достоверное увеличение хорошего неврологического исхода (50 % против 13 %) при отсутствии осложнений. В 2002 г. было проведено рандомизированное клиническое испытание при внегоспитальной остановке кровообращения ТГ у 43 больных (33 °С в течение 12 ч) в сравнении с 34 больными с нормотермией. В результате 49 % (21пациентов) в группе ТГ были выписаны из больницы с хорошим неврологическим исходом в сравнении с 26 % (9 человек) в группе контроля. Было отмечено, что ТГ вызывает гемодинамические эффекты: снижение СВ и повышение общего периферического сопротивления сосудов, при этом число случаев возникновения аритмий было идентично в обеих группах, других осложнений отмечено не было. В Европейское мультицентровое клиническое испытание (2002) с догоспитальной остановкой кровообращения было включено 273 больных, из них 136 больным индуцирована ТГ (33 °С в течение 24 часов). Через 6 месяцев отмечен хороший неврологический исход у 55 % в сравнении с 39 % при нормотермии. Число осложнений в группах было одинаковым. Однако было отмечено, что использование наружного охлаждения связано с низкой скоростью индукции ТГ — 0,3–0,9 °С в час и определенными техническими трудностями по подключению гипотерма, что приводило к задержке начала ТГ. При этом было показано, что чем раньше начата гипотермия, тем лучше неврологический исход. Последнее и стимулировало использование внутривенного метода индукции ТГ как более быстрой методики с более высокой скоростью охлаждения и более управляемой [9–11]. Согласно современным рекомендациям Европейского совета по реанимации 2005 года, пациентам без сознания, перенесшим остановку кровообращения во внебольничных условиях по механизму фибрилляции желудочков, необходимо обеспечить проведение гипотермии тела до 32–34 °С в течение 12–24 часов. Этот же режим гипотермии рекомендован пациентам с другими механизмами остановки, а также в случае внутрибольничных остановок кровообращения [16]. На рис. 3 представлен алгоритм интенсивной терапии постреанимационной болезни.
В заключение необходимо подчеркнуть, что неврологическое восстановление продолжает оставаться лимитирующим фактором СЛЦР, несмотря на почти 40-летний период научных изысканий, и пока делаются первые шаги на пути решения данной проблемы, что обусловлено крайней сложностью механизмов повреждения нейронов, запускаемых ишемией и реперфузией, мультифакторностью природы и недостаточной изученностью.
Список литературы / References 1. Гурвич А.М. Значение нейрофизиологических механизмов в постреанимационной патологии и постреанимационном восстановлении функций ЦНС // Экспериментальные, клинические и организационные проблемы реаниматологии. — М.: НИИОР, 1996. — С. 11-23. 2. Золотокрылина Е.С. Постреанимационная болезнь: этиология, патогенез, клиника, лечение // Реаниматология и интенсивная терапия. — 1999. — № 1. — С. 8-18. 3. Неговский В.А., Гурвич А.М., Золотокрылина Е.С. Постреанимационная болезнь. — М.: Медицина, 1987. — 480 с. 4. Неговский В.А., Гурвич А.М. Постреанимационная болезнь — новая нозологическая единица. Реальность и значение // Экспериментальные, клинические и организационные проблемы реаниматологии. — М.: НИИОР, 1996.— С. 3-10. 5. Семченко В.В., Степанов С.С., Алексеева Г.В. Постаноксическая энцефалопатия. — Омск, 1999. — 448 с. 6. Усенко Л.В., Клигуненко Е.Н. Перфторан в интенсивной терапии критических состояний. — Днепропетровск, 2000. — С. 45-54. 7. Усенко Л.В., Мальцева Л.А., Царев А.В. Сердечно-легочная и церебральная реанимация: новые рекомендации Европейского совета по реанимации 2005 г. и нерешенные проблемы реаниматологии на Украине // Медицина неотложных состояний. — 2006. — № 4. — С. 17-22. 8. Усенко Л.В., Царев А.В. Сердечно-легочная и церебральная реанимация с позиций доказательной медицины // Біль, знеболювання і інтенсивна терапія. — 2004. — № 1. — С. 50-68. 9. Alzaga A.G., Gordan M., Varon J. Therapeutic hypothermia // Resuscitation. — 2006. — 70(3). — P. 369-380. 10. Behringer W., Bernard S., Holzer M., Polderman K., Tiaineu M., Roine R.O. Prevention of postresuscitation neurologic dysfunction and injury by the use of therapeutic mild hypothermia // Cardiac Arrest: The science and practice of resuscitation medicine / Ed. by N.A. Paradis, A.R. Halperin, K.B. Kern, V. Wenzel, D.A. Chamberlaine. — 2nd ed. — Cambridge: Cambridge University Press, 2007. — P. 848-884. 11. Bernard S.A., Buist M. Induced hypothermia in critical care medicine: A review // Critical Care Medicine. — 2003. — 31(7). — P. 2041-2051. 12. Cerchiari E.L. Postresuscitation syndrome // Cardiac Arrest: The science and practice of resuscitation medicine / Ed. by N.A. Paradis, A.R. Halperin, K.B. Kern, V. Wenzel, D.A. Chamberlaine. — 2nd ed. — Cambridge: Cambridge University Press, 2007. — P. 817-828. 13. Embeyer U., Katz L.M., Ward K.R., Neumar R.W. Bringing all together: brain-oriented postresuscitation critical care // Cardiac Arrest: The science and practice of resuscitation medicine / Eds. by N.A. Paradis, A.R. Halperin, K.B. Kern, V. Wenzel, D.A. Chamberlaine. — 2nd ed. — Cambridge: Cambridge University Press, 2007. — P. 902-918. 14. Muniz A.E. Postresuscitation cerebral dysfunction: prevention and treatment // Cardiopulmonary Resuscitation / Ed. by J.P. Ornato, M.A. Peberdy. — Totowa, NJ: Humana Press, 2005. — P. 523-608. 15. Negovsky V.A. The second step in resuscitation: the treatment of the post-resuscitation disease // Resuscitation. — 1972. — 1. — P. 1-7. 16. Nolan J.P., Deakin C.P., Soar J., Bottiger B.W., Smith G. Adult advanced life support // European Resuscitation Council Guidelines for Resuscitation 2005 / Ed. by J.P. Nolan, P. Baskett. — Elsevier, 2005. — S. 39-86. 17. Safar P. Cerebral resuscitation from temporary complete global brain ischemia // Cerebral Blood Flow: mechanisms of ischemia, diagnosis, and therapy / Ed. by M.R. Pinsky. — Springer, 2002. — P. 106-136.
|