Ацетилхолин
По химическому строению ацетилхолин представляет собой соединение двух молекул — азотсодержащего холина и остатка уксусной кислоты:
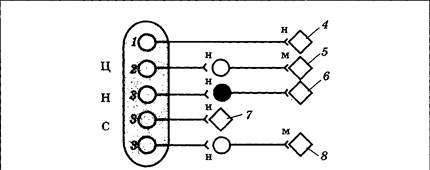
Холин является незаменимым витаминоподобным соединением, получаемым с пищей в достаточном количестве, и последствия его дефицита наблюдаются только в искусственных условиях. Синтез ацетилхолина осуществляется в основном в пресинаптических окончаниях с помощью фермента холинацетилтрансферазы. Затем медиатор переносится в пустые везикулы и хранится в них до момента выброса. Ацетилхолин в качестве медиатора работает в трех функциональных блоках нервной системы: в нервно-мышечных синапсах, периферической части вегетативной нервной системы и некоторых областях ЦНС. Ацетилхолин является медиатором мотонейронов нервной системы, которые расположены в передних рогах серого вещества спинного мозга и двигательных ядрах черепных нервов. Их аксоны направляются к скелетным мышцам и, разветвляясь, образуют нервно-мышечные синапсы. При этом один аксон может устанавливать контакт с сотнями мышечных волокон, но каждое мышечное волокно управляется только одним синапсом. Размер нервно-мышечных синапсов в десятки раз больше, чем синапсов в ЦНС, и пришедший по аксону мотонейрона даже одиночный ПД вызывает выделение значительного количества ацетилхолина (этап I, рис. 3.24). В результате развивающаяся на постсинаптической мембране деполяризация оказывается настолько велика, что всегда запускает ПД мышечной клетки (II), который приводит к выбросу Ca2+ из каналов ЭПС (III), активации двигательных белков и сокращению (IV). Периферическое звено вегетативной нервной системы состоит из двух нейронов: тело первого (преганглионарного) находится в ЦНС, а аксон направляется к вегетативному ганглию; тело второго (постганглионарного) находится в ганглии, а аксон иннервирует гладкие мышечные или железистые клетки внутренних органов. Ацетилхолин в качестве медиатора вырабатывается во всех преганглионарных клетках, а также в постганглионарных клетках парасимпатической части вегетативной нервной системы (рис. 3.25). Некоторые постганглионарные симпатические волокна (активирующие потовые железы и вызывающие расширение сосудов) также секретируют ацетилхолин.
В ЦНС ацетилхолин вырабатывается частью нейронов ретикулярных ядер моста и интернейронами полосатого тела базальных ганглиев и некоторых других локальных зон. Рассматривается роль этого медиатора в регуляции уровня бодрствования, а также в системах памяти, двигательных системах. Доказана эффективность применения антагонистов ацетилхолина при ряде двигательных нарушений. Выделяясь из пресинаптического окончания, ацетилхолин действует на постсинаптические рецепторы. Эти рецепторы неоднородны и различаются локализацией и рядом свойств. Выделено два типа рецепторов (рис. 3.26): первый, помимо ацетилхолина, возбуждается под действием алкалоида табака никотина (никотиновые рецепторы), второй тип активируется ацетилхолином и токсином мухомора мускарином (мускариновые рецепторы).
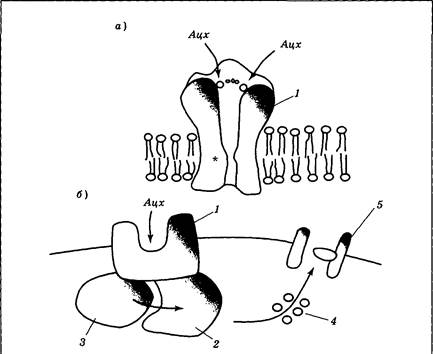
Никотиновые рецепторы являются классическим примером ионотропных рецепторов: их ионный канал входит в состав рецептора и открывается сразу после присоединения ацетилхолина. Канал этот характеризуется универсальной проницаемостью для положительно заряженных ионов, но в обычных условиях (при открытии на фоне ПП) в связи с никотиновыми рецепторами наблюдается в основном входящий Na+-ток, вызывающий деполяризацию мембраны и возбуждение нейрона. Никотиновые рецепторы расположены на постсинаптической мембране поперечно-полосатых волокон скелетных мышц (нервно-мышечные синапсы); в синапсах вегетативных ганглиев и в меньшем количестве, чем мускариновые рецепторы, в ЦНС. Областью, наиболее чувствительной к никотину, являются вегетативные ганглии, поэтому первые попытки курения приводят к значительным нарушениям в деятельности органов: скачкам артериального давления, тошноте, головокружению. По мере привыкания сохраняется в основном симпатический компонент действия: никотин начинает работать преимущественно как стимулятор многих систем организма. Присутствует также и центральное активирующее влияние (на головной мозг) ацетилхолина. Сверхдозы никотина (50 и более мг) вызывают резкое учащение сердцебиения, судороги и остановку дыхания.
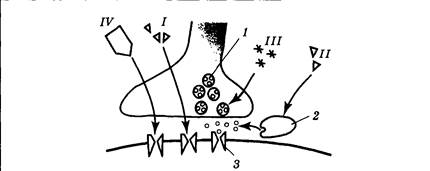
Во время курения никотин действует как слабый наркотический препарат-стимулятор, вызывая развитие не только привыкания, но и зависимости. Наркотическая зависимость — это ситуация, когда организм включает поступающий извне препарат в свой метаболизм, т. е. начинает «рассчитывать» на его постоянный приток. При отказе от препарата происходит сбой в использующих его системах мозга: наблюдается резкое ухудшение самочувствия, депрессия (абстинентный синдром или синдром отмены). Человеку, попавшему в зависимость, наркотик необходим уже не столько для того, чтобы почувствовать бодрость и эйфорию, сколько для возврата хотя бы к относительно нормальному уровню жизнедеятельности. Наиболее известным антагонистом никотиновых рецепторов является тубокурарин — активное действующее начало яда некоторых южноамериканских растений. Основным «местом приложения» его влияния являются нервно-мышечные синапсы (рис. 3.27, вариант I). При этом происходит последовательное расслабление и паралич мышц пальцев, затем глаз, рук и ног, шеи, спины и, наконец, дыхательных. Мускариновые рецепторы являются метаботропными (рис. 3.26, б); они связаны с G-белками, и присоединение к ним ацетилхолина приводит к синтезу вторичных посредников. Выделяют две основные локализации мускариновых рецепторов: синапсы, образуемые постганглионарными (в основном парасимпатическими) вегетативными волокнами и ЦНС. В первом случае в качестве вторичных посредников используются инозитолтрифосфат и диацилглицерол; во втором — цГМФ. Ионные последствия возбуждения мускариновых рецепторов весьма разнообразны: в сердце наблюдается увеличение проводимости для ионов К+, что приводит к гиперполяризации и снижению частоты сокращений; в гладких мышцах отмечаются изменения проводимости как для К+, так и для Na+ (возможна гипер- или деполяризация в зависимости от конкретного органа). В ЦНС отмечается снижение проницаемости мембраны для К+ (деполяризация; возбуждающее действие), но синапсы, содержащие мускариновые рецепторы, могут располагаться как на тормозных, так и на возбуждающих нейронах коры и базальных ганглиев. В связи с этим последствия блокады либо активации мускариновых рецепторов на поведенческом уровне оказываются очень индивидуальны; их выраженность и направленность зависит от конкретной химической структуры того или иного препарата. Эффекты мускарина носят преимущественно парасимпатический характер: при отравлении мухоморами наблюдается тошнота, повышенное пото- и слюноотделение, слезотечение, боли в животе, снижение артериального давления и сердечной активности. Классическим антагонистом мускариновых рецепторов является атропин — токсин белены и дурмана. Его периферические эффекты прямо противоположны действию мускарина: происходит снижение тонуса мышц желудочно-кишечного тракта, учащается сердцебиение, прекращается слюноотделение (сухость во рту), расширяются зрачки, наблюдаются и центральные эффекты (двигательное и речевое возбуждение, галлюцинации).
Инактивация ацетилхолина происходит непосредственно в синаптической щели. Ее осуществляет фермент ацетилхолинэстераза, разлагающий медиатор до холина и остатка уксусной кислоты, затем холин всасывается в пресинаптическое окончание и может вновь использоваться для синтеза ацетилхолина. Ацетилхолинэстераза имеет активный центр, узнающий холин, и один активный центр, «отрывающий» ацетильную группу от исходной молекулы. Последний часто является местом атаки специфических блокаторов (рис. 3.27, вариант II). Примером подобного блокатора служит прозерин (неостигмин), применяемый при миастении, которая встречается примерно у трех человек на тысячу (чаще у женщин). Симптомами заболевания служат быстрая мышечная утомляемость, непроизвольное опускание век, замедленное жевание. Такие больные очень чувствительны к тубокурарину, а введение блокаторов ацетилхолинэстеразы ослабляет патологические проявления. В настоящее время известно, что у значительной части больных миастенией число никотиновых рецепторов примерно на 70% меньше, чем в норме. Причина этого состоит в том, что иммунная система больного вырабатывает антитела на никотиновые рецепторы. Эти антитела ускоряют разрушение рецепторов на мембране, ослабляя передачу в нервно-мышечном синапсе (рис. 3.27, вариант IV). Прозерин и сходные с ним препараты называют обратимыми блокаторами ацетилхолинэстеразы, их действие прекращается через несколько часов после введения, кроме того, существуют необратимые блокаторы того же фермента. В этом случае вещество, нарушающее работу ацетилхолинэстеразы, вступает с белком в устойчивую химическую связь и выводит его из строя. Таким образом действуют фосфорорганические соединения, применяемые как препараты против насекомых (инсектициды): хлорофос, тиофос и сходные с ними соединения могут вызвать у человека сужение зрачков, потливость, снижение артериального давления, подергивания мышц. Еще более сильными агентами-блокаторами являются различные нервно-паралитические газы (зарин): легко проникая через все барьеры организма, они вызывают судороги, потерю сознания и паралич. Смерть наступает от остановки дыхания. Для немедленного ослабления эффектов отравляющих газов рекомендуется использование атропина; для восстановления деятельности ацетилхолинэстеразы — особые вещества-реактиваторы, «отрывающие» блокатор от фермента. Другим примером разрушительного действия на ацетилхолинергический (использующий ацетилхолин в качестве медиатора) синапс являются нейротоксины змей. Например, яд кобры содержит альфа-нейротоксин, необратимо связывающийся с никотиновым рецептором и блокирующий его, а также бета-нейротоксин, который тормозит выделение медиатора из пресинаптического окончания (рис. 3.27, варианты I, III).
|