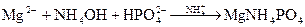Опыт 3. Карбонат и гидрокарбонат натрия.
А. Реакция среды в растворе карбоната и гидрокарбоната натрия.
H2O + фенолфталеин = бесцветный, нейтральная среда. а) щелочная среда; Na2CO3 + H2O = NaHCO3 + NaOH
2Na+ + CO32- + H2O = Na+ + HCO3- + Na+ + OH-
CO32- + H2O = HCO3- + OH-
б) щелочная среда; NaHCO3 + H2O = NaOH + H2CO3
Na+ + HCO3- + H2O = Na+ + OH- + 2H+ + CO32-
HCO3- + H2O = H2CO3 + OH -
В растворе гидрокарбоната натрия окраска фенолфталеина слабей, так как NaHCO3 кислая соль.
Б. Термическое разложение гидрокарбоната натрия.
1) Поместили фарфоровую чашечку 3–4 микрошпателя порошка гидрокарбоната натрия и прокалили содержимое пламенем горелки в течение 10–15 мин. 2) Охладили тигель на воздухе, внесли в него 12–14 капель дистиллированной воды, перемешали стеклянной палочкой.
2NaHCO3 = Na2CO3 + CO2↑ + H2O 2HCO3- = СO3-2 + CO2↑ + H2O
3) Разделили раствор на две пробирки. В одну из пробирок добавить 3–4 капли 2 н. раствора хлороводородной кислоты и наблюдали выделение пузырьков газа. Na2СO3 + 2HCl = CO2↑ + 2NaCl + H2O СO3--2 + 2Н+ = СО2↑ + Н2О
4) В другую пробирку к полученному раствору прибавить такое же количество раствора фенолфталеина. Na2CO3 + фенолфталеин = малиновая окраска III. Щелочноземельные металлы. Оборудование и реактивы. В штативе: хлорид кальция, нитрат стронция, хлорид бария, сульфат магния, карбонат натрия, хлорид аммония, гидроортофосфат натрия, сульфат натрия, хромат калия, гидроксид аммония, гидроксид натрия (калия) – растворы, концентрацией 5 %. В вытяжном шкафу: соляная кислота – раствор концентрацией 15 %, уксусная кислота – 2 н. раствор. Получать в лаборантской: пробирки – 5 шт.; фарфоровая чашка – 1 шт., спиртовка – 1 шт., универсальная индикаторная бумага, сульфат кальция – насыщенный раствор.
Опыт 1. Окрашивание пламени горелки. Соль Ca - темно-оранжевого пламя. Соль Sr - темно-красного пламя. Соль Ba - светло-зеленого пламя. Опыт 2. Образование карбонатов. 1) 2MgSO4 + 2Na2CO3 + H2O → (MgOH)2CO3 + CO2↑ + 2Na2SO4 – белый осадок 2Mg2+ + CO3—2 + Н2О→ 2MgOH-- + CO2↑ 2) CaCl2 + Na2CO3 → СaCO3↓ + 2NaCl – белый осадок Ca+2 + CO3—2 → CaCO3↓ 3) SrCl2 + Na2CO3 → SrCO3↓ + 2NaCl – белый осадок Sr+2 + CO3—2→SrCO3↓ 4) BaCl2+2MgSO4+2NH4Cl+2Na2CO3+H2O→BaCO3↓+2Na2SO4+2NH4OH+2MgCl2+CO2↑ Ba+2 + 2CO3—2 + H2O → BaCO3↓ + 2ОН-- + CO2↑ 5) BaCO3 + 2HCl → BaCl2 + H2O + CO2↑ BaCO3 + 2Cl-- → Ba+2+H2O+CO2↑ А. Объяснение к уравнению №4: Mg2+ – катион слабого основания; Б. Объяснение к уравнению №5: По кислотным свойствам соляная кислота гораздо сильнее, чем угольная, Поэтому происходит реакция замещения. Более сильная кислота замещает более слабую. Опыт 3. Образование труднорастворимого фосфата аммония, магния (качественная реакция). MgSO4+NH4Cl+Na2HPO4+NH4OH→MgNH4PO4↓+NaHSO4+NaCl-выпал белый осадок
Опыт 4. Осаждение гидроксида магния.
MgSO4 + 2NH4OH → Mg(OH)2 + (NH4)2SO4 - выпал белый аморфный осадок
Mg+2 + 2ОН-- → Mg(OH)2↓
Так как гидроксид аммония (NH4OH) – очень слабое основание, а сульфат магния в растворе имеет, кислую среду, чтобы образовался гидроскид магния надо добавить щелочи. Если провести ту же реакцию в присутствии хлорида аммония, то осадка образовываться не будет, так как при гидролизе NH4Cl образуется кислая среда, которая препятствует образованию гидроксида магния.
Опыт 5. Различия в растворимости сульфатов щелочно-земельных металлов. А.
1) MgCl2 + Na2SO4 → реакция не идет, так как не образуется нерастворимая соль 2) CaCl2 + Na2SO4 → CaSO4↓ + 2NaCl Ca+2 + SO4-2 → CaSO4↓ 3) SrCl2 + Na2SO4 → SrSO4↓ + 2NaCl Sr+2 + SO4-2 → SrSO4↓
4) BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl Ba+2 + SO4-2 → BaSO4↓ Сульфат бария наименее растворим. Растворимость сульфатов щелочноземельных металлов от магния к барию уменьшается. BaSO4+HCl≠; Эта реакция не идет, так как серная кислота более сильная, чем соляная и поэтому реакции замещения не протекает. Б. 1) SrCl2 + CaSO4 → SrSO4↓ + CaCl2 – медленное образование осадка Sr+2 + SO4-2 → SrSO4↓ 2) BaCl2 + CaSO4 → BaSO4↓ + CaCl2 - быстрое образование осадка Ba+2 + SO4-2 → BaSO4↓ Осадки сульфатов щелочноземельных металлов получаются из-за малых произведений растворимости.. Опыт 6. Образование и растворение хромата бария. 1) BaCl2 + K2CrO4 → BaCrO4↓ + 2KCl – выпал желтый осадок Ba+2 + CrO4—2 → BaCrO4↓ 2) BaCrO4 + 2HCl → BaCl2 + H2CrO4 BaCrO4 → Ba+2 + CrO4--2 3) ВaCrO4 + CH3COOH≠ т.к. слабая кислота Хромат бария реагирует с соляной кислотой, так как она гораздо сильнее уксусной. Вывод. Я изучил свойства водорода, щелочных и щелочноземельных металлов.
|

 – остаток слабой кислоты. Следовательно, будет реакция взаимного усиления гидролиза
– остаток слабой кислоты. Следовательно, будет реакция взаимного усиления гидролиза  , который подавляется в присутствии NH4Cl, т.к. при гидролизе NH4Cl получается кислая среда: (MgOH)2CO3 + NH4+ + H2O = Mg2+ + NH4OH + CO2, а образующегося гидроксида аммония недостаточно для образования осадка Mg(OH)2.
, который подавляется в присутствии NH4Cl, т.к. при гидролизе NH4Cl получается кислая среда: (MgOH)2CO3 + NH4+ + H2O = Mg2+ + NH4OH + CO2, а образующегося гидроксида аммония недостаточно для образования осадка Mg(OH)2.