Химические свойства. Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к йоду. Фтор — самый активный из галогенов,реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например: 2Аl + 3F2 = 2АlF3 + 2989 кДж, 2Fе + 3F2 = 2FеF3 + 1974 кДж. Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например: Н2 + F2 = 2НF + 547 кДж, Si + 2F2 = SiF4(г) + 1615 кДж. При нагревании фтор окисляет все другие галогены по схеме Hal2 + F2 = 2НаlF где Наl = Сl, Вr, I, причем в соединениях НаlF степени окисления хлора, брома и иода равны +1. Наконец, при облучении фтор реагирует даже с инертными (благородными) газами: Хе + F2 = ХеF2 + 152 кДж. Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер: 3F2 + ЗН2О = F2О↑ + 4НF + Н2О2. Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами,за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора: 2Аl + ЗСl2 = 2АlСl3(кр) + 1405 кДж, 2Fе + ЗСl2 = 2АlСl3(кр) + 804 кДж, Si + 2Сl2 = SiCl4(Ж) + 662 кДж, Н2 + Сl2 = 2НСl(г)+185кДж. Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом,тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму: Cl2 + hv → 2Сl, Сl + Н2 → НСl + Н, Н + Cl2 → НСl + Сl, Сl + Н2 → НCl + Н и т.д. Возбуждение этой реакции происходит под действием фотонов (hv),которые вызывают диссоциацию молекул Сl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица,инициирующая начало последующей стадии. Реакция между Н2 и Сl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внес русский ученый, лауреат Нобелевской премии (1956 г) Н.Н. Семенов. Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами: СН3-СН3 + Сl2 → СН3-СН2Сl + НСl, СН2=СН2 + Сl2 → СН2Cl - СН2Сl. Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами: Сl2 + 2НВr = 2НСl + Вr2, Сl2 + 2НI = 2НСl + I2, Сl2 + 2КВr = 2КСl + Вr2, а также обратимо реагирует с водой: Сl2 + Н2О Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой. Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала -1 (в НСl), у других+1 (в хлорноватистой кислоте НОСl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования. Хлор может таким же образом реагировать (диспропорционировать) с щелочами: Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде), ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагревании). Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Для примера приведем реакции взаимодействия брома с кремнием и водородом: Si +2Вr2 = SiBr4(ж) + 433 кДж, Н2 + Вr2 = 2НВr(г) + 73 кДж. Являясь более «мягким» реагентом, бром находит широкое применение в органической химии. Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду»,тогда как йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды». Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов,а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании,реакция является эндотермической и сильно обратимой: Н2 + I2 Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в ряду F - I может вытеснять последующий из его соединений с водородом или металлами, т.е. каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов: Получение Промышленное получение фтора и хлора связано с электролитическими процессами. Ввиду высокой окислительной активности фтора его получают исключительно электролизом расплавов фторидов металлов (в том числе и в лабораториях); хлор получают электролизом как расплавов, так и растворов хлоридов. Бром и йод получают химическим способом. При электролизе расплава хлорида натрия (Тпл = 801°С) на катоде выделяется металлический натрий, а на аноде — газообразный хлор. Электролитическая ванна (электролизер) представляет собой футерованный огнеупорным кирпичом стальной сосуд. В качестве анода используют графитовые стержни, в качестве катода — стальной цилиндр. В верхней части ванны имеется устройство для сбора хлора(колокол). Выделяющийся в катодном пространстве металлический натрий собирают в коллектор(устройство для сбора натрия без доступа воздуха). Таким образом, электролиз расплава NaCl — способ одновременного получения хлора и металлического натрия. Электролизом водного раствора NаСl получают одновременно Н2, Сl2 и гидроксид натрия NаОН. Обычно электролизу подвергают насыщенный водный раствор NaCl (рассол), подаваемый в электролизер сверху. Электролиз протекает по следующей схеме:
В этом процессе требуется предотвратить соприкосновение выделяющегося на аноде хлора с накапливающимся у катода раствором гидроксида натрия(получающийся в этом случае NaOH имеет давнее техническое название «каустическая сода»), так как эти вещества могут реагировать между собой.Именно по этой причине анодное пространство обязательно отделяется от катодного полупроницаемой диафрагмой из асбеста Для получения брома и йода также можно использовать электролиз их солей, однако на практике обычно окисляют их соли,применяя в качестве окислителя хлор. Такой метод оказывается выгодным экономически, так как Сl2 сравнительно дешевый реагент,а иодиды, и особенно бромиды, просто «черпают» из морской воды (!). Лабораторные способы получения галогенов. Хлор получают действием различных окислителей на соляную кислоту, например: МnО2 + 4НСl = МnСl2 + Сl2↑ + 2Н2О. Еще более эффективно окисление проводится такими окислителями, как РbО2, КМnО4, КСlO3, К2Сr2О7. Аналогично получают в лабораториях бром и иод, окисляя НВr, НI или их соли. В качестве примера кратко опишем здесьпрактически используемую лабораторную методику получения брома по реакции: 6КВr + К2Сr2О7 +7Н2SО4 = ЗВr2 + Сr2(SО4)3 + 4К2SО4 + 7Н2О. В колбу 1 Соединения галогенов. Галогеноводороды, галогеноводородные кислоты и галогениды. Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемая в их молекулах,— ковалентная полярная, причем полярность связи в ряду НF - НСl - НВr - НI падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности,все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить 400 объемов НСl, 530объемов НВr и около 400 HI.
|

 НСl + НСlO - 25 кДж.
НСl + НСlO - 25 кДж.
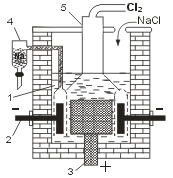
 .Диафрагма препятствует проникновению газа (молекул Сl2) в катодное пространство, но не препятствует прохождению электрического тока и ионов.
.Диафрагма препятствует проникновению газа (молекул Сl2) в катодное пространство, но не препятствует прохождению электрического тока и ионов.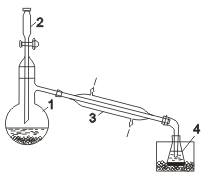 соединенную с холодильником 3 и приемником 4, помещают смесь бромида калия и бихромата калия капельной воронки 2, пришлифованной к горлу колбы, приливают по каплям концентрированную серную кислоту. Реакционная смесь в ходе реакции разогревается, и ввиду низкой температуры кипения брома для конденсации его паров применяют холодильник, непрерывно охлаждаемый проточной водой. Жидкий бром собирают под слоем воды, предварительно охлажденной снегом или охладительной смесью.
соединенную с холодильником 3 и приемником 4, помещают смесь бромида калия и бихромата калия капельной воронки 2, пришлифованной к горлу колбы, приливают по каплям концентрированную серную кислоту. Реакционная смесь в ходе реакции разогревается, и ввиду низкой температуры кипения брома для конденсации его паров применяют холодильник, непрерывно охлаждаемый проточной водой. Жидкий бром собирают под слоем воды, предварительно охлажденной снегом или охладительной смесью.


