Результаты работы.
3.1. Собрать и промоделировать в пакете MultiSim 9 схему блока управления, приведенную на рис. 8. С помощью четырехканального осциллографа XCS1 определить задержки сигналов, вырабатываемых блоком управления относительно сформированного импульса To. 3.2. Определить на каких входах осциллографа XCS1 присутствуют сигналы То, записи и обнуления. 3.3. Определить, от каких интегрирующих и дифференцирующих цепочек, образованных резисторами и конденсаторами зависят задержки между сигналами. Рассчитать и промоделировать задержки между сигналами увеличенные и уменьшенные в два раза относительно полученных по схеме рис. 8. Для того чтобы максимально приблизить время моделирования схемы к реальному времени необходимо произвести соответствующие установки в настройке программы моделирования MultiSim 9 согласно рис. 6. 3.4. Собрать и промоделировать в пакете MultiSim 9 схему ЦОУ, приведенную на рис. 5. 3.5. Объединить схемы блока управления и ЦОУ в схему частотомера, подключив сигналы записи и обнуления от блока управления к соответствующим точкам схемы ЦОУ. Селектор С организовать из оставшегося элемента микросхемы D2 (в ней содержится 4 элемента 2И-НЕ). На вход частотомера подать сигнал с функционального генератора XFG2 треугольной формы амплитудой 5В. Частоту следования входных импульсов можно менять в пределах 1 – 9999 Гц. Для того чтобы максимально приблизить время моделирования схемы к реальному времени необходимо произвести соответствующие установки в настройке программы моделирования MultiSim 9 согласно рис. 6. При подаче входного сигнала с большим (более 100 Гц) значением частоты следования время моделирования может быть достаточно большим. 3.6. Проинвертировать сигнал записи. Объяснить, что происходить в схеме ЦОУ с таким подключением сигнала записи. Кафедра химии
Лабораторная работа №2
Фазовое равновесие. Диаграмма состояния фенол-вода
по дисциплине «Общая, неорганическая и физическая химия»
Специальность 1-53 01 01«Автоматизация технологических процессов и производств» Специализация: 1-53 01 01-04 «Автоматизация технологических процессов и производств»
Проверила Выполнили студенты группы АТПП - 111 ____________ Н.В. Брановицкая «____» ____________2013 г _______________________ _______________________ _______________________ _______________________ . «____»____________ 2013 г.
Могилев 2013 1. Цель работы – познакомиться с графическим описанием диаграмм состояния двухкомпонентных систем на примере диаграммы растворимости фенол–вода. Исследовать зависимость температуры фазовых превращений в системе фенол–вода от ее состава.
2. Оборудование и реактивы. Работа выполняется с использованием запаянных стеклянных пробирок, содержащих фенол и воду, с определенной концентрацией фенола (10, 20, 30, 40, 50, 60 и 70 масс. %). Эти пробирки нагреваются на водяной бане, и термометром фиксируется с точностью ± 0,1 ºС температура исчезновения одной из фаз и ее образования при охлаждении. Для каждого состава измерения повторяются до тех пор, пока не будет получено согласование температур при нагреве и охлаждении в пределах ± 1 ºС. Средний результат измерений при нагревании и охлаждении округляется до 0,5 ºС и заносится в таблицу.
3. Теоретическое введение – в соответствии с [3], с. 85–87.
4. Методика выполнения (ход работы) – в соответствии с [4], с. 17–19. Результаты работы.
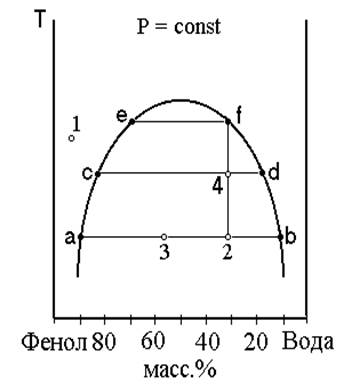
Полученные разными бригадами результаты необходимо представить в форме таблицы 1. Схема диаграммы состояния фенол–вода показана на рисунке 1.
Рисунок 1 – Схема диаграммы состояния фенол–вода
Таблица 1 – Результаты измерения температуры фазовых превращений
Средние величины (± 0,5 ºС) используются для построения диаграммы состояния фенол-вода. Диаграмма состояния строится на миллиметровой бумаге, масштаб оси составов – 100 мм. 6. Заключение (выводы): – проведено ознакомление с графическим описанием диаграмм состояния двухкомпонентных систем на примере диаграммы растворимости фенол–вода; – исследована зависимость температуры фазовых превращений в системе фенол–вода от ее состава; – построена диаграмма растворимости фенол–вода Вопросы для зачета лабораторной работы (по рисунку 1). 1) Понятия «фаза», «компонент», «степень свободы». Правило фаз Гиббса. Определение числа компонентов в системе. 2) Состав системы (фигуративная точка) и состав фаз – всегда ли они совпадают? 2) Сколько фаз и какого состава находятся в точках 1 и 2? Сколько в этих точках степеней свободы? 3) Каковы качественные отличия растворов в точках 1 и 2? 4) Что такое нода, проведите ее через заданную точку в гетерогенной области. Какую можно при этом получить информацию о системе? 5) Что произойдет в системе (фигуративная точка 2), если в нее добавить немного воды? Изменится ли количество фаз, их масса и состав? 6) Каково число степеней свободы в фигуративной точке при ее движении по ноде? 7) Что происходит в системе (точка 2) при ее нагревании до (·)f? Как при этом изменяется состав и масса сосуществующих фаз? Что происходит при охлаждении раствора, нагретого выше (·)f? Индивидуальное задание по теме – задача 8 [2]. 8. Список литературы: 1) Общие требования и правила оформления текстовых документов: СТП СМК 4.2.3 - 01-2011. – Могилев: МГУП, 2011. – 43 с. 2) Методические указания и контрольные задания для студентов технологических специальностей заочной формы обучения. Часть 1. / Могилевский государственный университет продовольствия; О.Г. Поляченок, Е. Н Дудкина, Л.Д. Поляченок. – Могилев, 2010. – 44 с. 3) Поляченок, О.Г. Физическая и коллоидная химия. Конспект лекций / О.Г. Поляченок, Л.Д. Поляченок. – Могилев: МГУП, 2008. – 196 с. 4) Волкова, Э.С. Фазовые равновесия. Методические указания к лабораторным занятиям / Э.С. Волкова, А.В. Оботуров, Т.А. Полякова. – Могилев: МГУП, 2003. – 24 с.
|