Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Рассмотрим пример составления окислительно-восстановитель-ной реакции между перманганатом калия (KMnO4) и сульфидом калия (K2S) в кислой среде (H2SO4): KMnO4 + K2S + H2SO4 1. Определяем степени окисления элементов в исходных веществах и продуктах реакции:
В данной реакции изменяются степени окисления атомов серы от –2 до 0 и марганца от +7 до +2. 2. Выбираем восстановитель и окислитель: Так как в данной реакции степень окисления серы повышается, а марганца понижается, то K2S – восстановитель, а KMnO4 – окислитель. 3. Определяем число электронов, отдаваемых восстановителем и принимаемых окислителем, и записываем схему перехода электронов, состоящую из уравнений процессов окисления и восстановления:
2 Mn+7 + 5
5S-2 + 2Mn+7 Для нахождения стехиометрических коэффициентов суммарной реакции первую реакцию умножаем на 5, вторую – на 2, так как число отданных восстановителем электронов должно равняться числу электронов, принятых окислителем. Коэффициенты перед веществами, атомы которых не изменяют свою степень окисления, находим методом подбора. 4. Записываем уравнение реакции с учетом найденных коэффициентов: 2KMnO4 + 5K2S + 8H2SO4 Правильность подобранных коэффициентов определяем балансом кислорода в обеих частях уравнения (8+32=8+24+8).
|

 K2SO4 + MnSO4 + S + H2O.
K2SO4 + MnSO4 + S + H2O.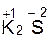 +
+ 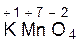 + H2SO4(среда)
+ H2SO4(среда)  +
+ 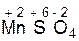 +
+ 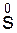 + H2O.
+ H2O. 5 S-2
5 S-2  (процесс окисления);
(процесс окисления);



