
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Суть банкрутства, його чинники та симптоми
Дата добавления: 2014-12-06; просмотров: 844
|
|
Проблема оценки структуры воды пока остается одной из самых сложных. Рассмотрим кратко две обобщенные гипотезы о структуре воды, получившие наибольшее признание, одна — в начальный период развития учения о структуре воды, другая — в настоящее время.
Согласно гипотезе, предложенной Уайтингом (1883г.) и имеющей к настоящему времени различные интерпретации, основной строительной единицей водяного пара является молекула H2O, называемая гидроль, или моногидроль. Основной строительной единицей воды является двойная молекула воды (H2O)2—дигидроль; лед же состоит из тройных молекул (H2O)3 — тригидроль. На этих представлениях основана так называемая гидрольная теория структуры воды.
Водяной пар, согласно этой теории, состоит из собрания простейших молекул моногидроля и их ассоциаций, а также из незначительного количества молекул дигидроля.
Вода в жидком виде представляет собой смесь молекул моногидроля, дигидроля и тригидроля. Соотношение числа этих молекул в воде различно и зависит от температуры. Согласно этой гипотезе, соотношение количества молекул воды и объясняет одну из основных ее аномалий — наибольшую плотность воды при 4°С.
В табл.1.1 показан молекулярный состав воды, льда и водяного пара по различным литературным источникам.
Так как молекула воды несимметрична, то центры тяжести положительных и отрицательных зарядов ее не совпадают. Молекулы имеют два полюса — положительный и отрицательный, создающие, как магнит, молекулярные силовые поля. Такие молекулы называют полярными, или диполями, а количественную характеристику полярности определяют электрическим моментом диполя, выражаемым произведением расстояния l между электрическими центрами тяжести положительных и отрицательных зарядов молекулы на заряд e в абсолютных электростатических единицах:
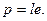
(1.6)
Для воды дипольный момент очень высокий: p = 6,13·10-29 Кл·м. Полярностью молекул моногидроля и объясняется образование дигидроля и тригидроля. Вместе с тем, так как собственные скорости молекул возрастают с повышением температуры, этим можно объяснить постепенный распад тригидроля в дигидроль и далее в моногидроль соответственно при таянии льда, нагревании и кипении воды.
Другая гипотеза строения воды, разрабатывавшаяся в XX веке (модели О.Я.Самойлова, Дж.Попла, Г.Н.Зацепиной и др.), основана на представлении, что лед, вода и водяной пар состоят из молекул H2O, объединенных в группы с помощью так называемых водородных связей (Дж.Бернал и Р.Фаулер, 1933г.). Эти связи возникают в результате взаимодействия атомов водорода одной молекулы с атомом кислорода соседней молекулы (с сильно электроотрицательным элементом). Такая особенность водородного обмена в молекуле воды обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом (см. рис.1.3), он остается в виде ядра, почти лишенного электронной оболочки. Поэтому атом водорода не испытывает отталкивания от электронной оболочки кислорода соседней молекулы воды, а, наоборот, притягивается ею, и может вступить с нею во взаимодействие.
Таблица 1.1
Молекулярный состав льда, воды и водяного пара, %
| Молекула | Лед | Вода | Пар | |||
| Температура, °С | ||||||
| Моногидроль [H2O] | >99,5 | |||||
| Дигидроль [(H2O)2] | <0,5 | |||||
| Тригидроль [(H2O)3] |
Согласно изложенному, можно предположить, что силы, образующие водородную связь, являются чисто электростатическими. Однако, согласно методу молекулярных орбиталей, водородная связь образуется за счет дисперсионных сил, ковалентной связи и электростатического взаимодействия.
Таким образом, в результате взаимодействия атомов водорода одной молекулы воды с отрицательными зарядами кислорода другой молекулы образуются четыре водородные связи для каждой молекулы воды. При этом молекулы, как правило, объединяются в группы — ассоциаты: каждая молекула оказывается окруженной четырьмя другими (рис. 1.4). Такая плотная упаковка молекул характерна для воды в замерзшем состоянии (лед Ih) и приводит к открытой кристаллической структуре, принадлежащей к гексогональной симметрии. При этой структуре образуются «пустоты — каналы» между фиксированными молекулами, поэтому плотность льда меньше плотности воды.

Рис.1.4.Схема взаимодействия молекул воды
1 — кислород, 2 — водород. 3 — химическая связь, 4 — водородная связь.
Повышение температуры льда до его плавления и выше приводит к разрыву водородных связей. При жидком состоянии воды достаточно даже обычных тепловых движений молекул, чтобы эти связи разрушить.
Считается, что при повышении температуры воды до 4°С упорядоченность расположения молекул по кристаллическому типу с характерной структурой для льда до некоторой степени сохраняется. Имеющиеся в этой структуре отмеченные выше пустоты заполняются освободившимися молекулами воды. Вследствие этого плотность жидкости увеличивается до максимальной при температуре 3,98°С. Дальнейший рост температуры приводит к искажению и разрыву водородных связей, а, следовательно, и разрушению групп молекул, вплоть до отдельных молекул, что характерно для пара.
| <== предыдущая лекция | | | следующая лекция ==> |
| Процедура санації та її виконавці | | | Причини і процедура ліквідації збанкрутілих підприємств |