Простой жир Смешанный жир
Т.О. мы говорим – жир, а на самом деле это – эфир! Эфир кислот и глицерина. Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R‘ - триглицерид стеариновой кислоты - ТРИСТЕАРИН), в состав смешанных — остатки различных кислот (1, 2–диолеил–3- пальмитилглицерин [смешанный триглицерил двух кислот – ОЛЕИНОВОЙ и ПАЛЬМИТИЛОВОЙ]. Жиры – главная составная часть жировых клеток животных и растений – являются одним из важнейших пищевых резервов организма. При окислении жиров выделяется значительно больше энергии, чем при окислении углеводов и белков. Три наиболее распространенные в природе жирные кислоты – это предельные кислоты: пальмитиновая (С16), стеариновая (С18) – и непредельная олеиновая (С18) кислота. У большинства ненасыщенных жирных кислот, входящих в состав жиров, масел и биологических мембран, преобладающим является цисизомер, трансизомер встречается редко. Чем выше степень ненасыщенности жирной кислоты, тем ниже ее температура плавления (табл). Также жирах наиболее часто встречаются следующие жирные кислоты: Ι) Алкановые кислоты (С2Н2n-1) 1. Масляная кислота СН3 — (CH2)2 — СООН 2. Капроновая кислота СН3 — (CH2)4 — СООН 3. Пальмитиновая кислота СН3 — (CH2)14 — СООН 4. Стеариновая кислота СН3 — (CH2)16 — СООН Ι Ι) Алкеновые кислоты (С2Н2n-2) 5. Олеиновая кислота С17Н33СООН СН3—(СН2)7—СН = СН—(СН2)7—СООН Ι Ι Ι) Алкадиеновые кислоты 6. Линолевая кислота С17Н31СООН СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН Ι V) Алкатриеновые кислоты 7. Линоленовая кислота С17Н29СООН СН3СН2СН = CHCH2CH = CHCH2CH = СН(СН2)4СООН 2 НОМЕНТКЛАТУРА И ИЗОМЕРИЯ ЖИРОВ Природные жиры (триацилглицерины) являются триэфирами глицерина и жирных кислот. Обычное название этих соединений – триглицериды. Известны не только глицериды одинаковых кислот (простые глицериды), но и преимущественно разных кислот (смешанные глицериды). Например: Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например: Для сложных эфиров характерны следующие виды изомерии: 1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат. 2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинаетсясо сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат. 3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота. Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
Жирные кислоты - относятся к группе карбоновых кислот. Карбоновые кислоты это такие органические кислоты, которые содержат в себе хотя бы одну карбоксильную группу. Классификация карбоновых кислот основана на количестве карбоксильных групп. Жирные кислоты относятся к монокарбоновым кислотам. С точки зрения химического строения все карбоновые кислоты делятся на две группы: 1) насыщенные или предельные карбоновые кислоты, в радикале которых встречаются только одинарные связи между атомами углерода. 2) непредельные или ненасыщенные, в радикале которых, встречаются двойные связи. Количество двойных связей является классификационным признаком, который обозначается суффиксом – ен. Биологическое значение имеют коротко радикальные предельные кислоты с С1 до С8.такие коротко радикальные кислоты являются важными промежуточными продуктами метаболических путей в клетке. После С8 биологическое значение имеют только жирные кислоты с четным количеством атомов углерода в радикале, т.к. все они синтезируются на основе уксусной кислоты. В организме встречаются предельные жирные кислоты до С24, с увеличением длинны радикала, изменяется фазовое состояние кислоты. Коротко радикальные жирные кислоты являются жидкостями. Чем длиннее радикал, тем тверже кислота. Среди непредельных жирных кислот биологическое значение имеет тетроеновые, пентоеновые и гексаеновые жирные кислоты. Пентоеновые и гексаеновые встречаются в рыбьем жире. Тетроеновая в арахисовом масле. Степень насыщенности жирной кислоты определяет ее фазовое состояние. Насыщенные жирные кислоты являются твердыми, ненасыщенные – жидкими. Молекулы жирных кислот сочетают в себе два свойства и гидрофобности и гидрофильности, поэтому говорят, что они обладают амфотерными свойствами. Если радикал жирной кислоты достаточно короткий, то она растворима в воде, если радикал длинный, то плохо растворима в воде. Простые липиды - это сложные эфиры жирных кислот и спиртов. Они образуются за счет реакции этерификации.
Все простые липиды делятся на три группы: 1) воска; 2) жиры; 3) Церамид
3 ВОСКА Это сложные эфиры жирной кислоты с одноатомным спиртом. Воска характерны для растительного мира и часто покрывают вегетативные органы растений, живущих в засушливых условиях (каменный плющ, кактусы, брусника). Препятствуют излишнему испарению воды, отражает солнечные лучи, что препятствует перегреванию растений и избыточному ультрафиолетовому облучению. Воска у животных менее распространены, у насекомых восковой налет покрывает кутикулу, препятствуя испарению воды. У человека также встречаются воска, которые выделяются на поверхность эпидермиса и производных эпидермиса, например волосы и ногти.
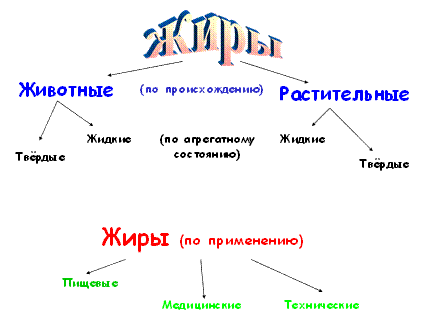
4 ЖИРЫ Это сложные эфиры жирных кислот с глицерином.
Агрегатное состояние жира при физиологических температурах зависит от того, какие жирные кислоты входят в его состав. Жиры, которые при физиологических температурах находятся в жидком состоянии, называются маслами. Жиры, которые при физиологических температурах находятся в твердо состоянии, называются жирами. Возможны различные варианты реакций с глицерином. С глицерином может прореагировать от 1 до 3 жирных кислот. • моноацилглицерол (МАГ)
• диацилглицерол (ДАГ)
• триацилглицерол (ТАГ)
5 ФИЗИЧЕСКИЕ СВОЙСТВА • Животные жиры плавятся при высокой t0C • Растительные жиры при низкой t0С • Высокая вязкость • Слабо проводят тепло и электричество • Плохо растворяются в воде • Растворяются в бензине, бензоле, хлороформе Температуры плавления индивидуальных триглицеридов, входящих в состав жиров, зависят от длины цепи, степени ненасыщенности жирных кислот и их расположения в триглицеридах. Подобно большинству длинноцепочных соединений, триглицериды могут кристаллизоваться в несколько полиморфных формах. Полиморфизм проявляют не только индивидуальные триглицериды, но и природные жиры, состоящие из триглицеридов с близкими длинами кислотных цепей. Жиры, являющиеся смесью различные триглицеридов, не имеют четкой температуры плавления. Все жиры характеризуются значительным увеличением объема при плавлении. При постепенном охлаждении жидкий жир частично кристаллизуется и приобретает форму твердого тела, обладающего пластичностью. Пластичность характерна для жиров, содержащих 10-30% кристаллич. фазы. В пластичном жире кристаллы твердых триглицеридов образуют решетку, внутри которой находится значительной количество жидкой фазы. При дальнейшем охлаждении все триглицериды кристаллизуются и жир теряет пластичность. Последняя является ценным свойством жиров, особенно пищевых. Важная характеристика жира - твердость, определяемая нагрузкой в г/см, необходимой для разрезания жира в определенных условиях. Жиры обладают низким давлением паров и кипят только в высоком вакууме (~ 250 °С при 0, 001 мм рт. ст.). Плотность жира зависит от молекулярной массы жирных кислот и степени их ненасыщенности и может быть рассчитана по формуле: d1515 = 0, 8475 + 0, 0003 числа омыления + 0, 00014 йодного числа. Температурный коэффициент объемного расширения жиров 0, 0007/К. Показатель преломления жира зависит от молекулярной массы жирных кислот и степени их ненасыщенности: nD40 = 1, 4643; 0, 000066 - числа омыления; 0, 0096 + 0, 0001171 йодного числа. Температурный коэффициент рефракции жира - 0, 0036/К. Из-за сильного межмол. взаимодействие жирно-кислотных цепей вязкость жира высока (η - 2-4 мкПа * с при 40 °С). Поверхностное натяжение большинства жиров на границе жир - воздух 30-35 мН/м. Энтальпия сгорания жира (в Дж/г) определяется формулой: — D Hсгор = 47645 - 4, 1868 йодного числа - 38, 31 числа омыления и для большинства жиров составляет 39, 5 кДж/г; D Hпл 120-150 Дж/г; Сор около 2 Дж/(г * К). Жиры плохие проводники тепла и электричества. Коэф. теплопроводности 0, 170 Вт/(м * К), диэлектрическая постоянная (30-40) * 10 - 30 Кл * м. Температура вспышки большинства жиров 270-330°С, температура самовоспламенения 340-360 °С; характеристикой ЖИРЫ является также так называемой температура дымообразования (дымления), при которой происходит визуально заметное образование дыма вследствие разложения ЖИРЫ Она падает с ростом кислотного числа ЖИРЫ и лежит в пределах 160-230°С. ЖИРЫ неограниченно растворим в диэтиловом эфире, бензоле, хлороформе, частично растворим в этаноле (5-10%) и ацетоне, практически не растворим в воде, но образуют с ней эмульсии. В 100 г воды эмульгируются 10 мг говяжьего жира, 50 мг свиного. Жиры растворяют небольшие количества воды (0, 1-0, 4%) и значительной кол-ва газов (7-10% по объему N2, H2, О2 и до 100% СО2). Растворимость Н2, N2, O2 возрастает с ростом температуры, растворимость СО2 падает. 6 ХИМИЧЕСКИЕ СВОЙСТВА ЖИРОВ • гидролиз • гидрирование • прогоркание • омыление
|