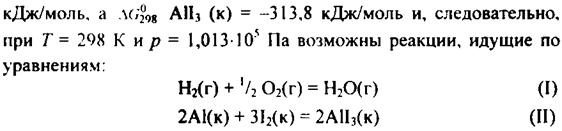Химическая кинетика и равновесие
Однако эти реакции при стандартных условиях идут только в Пример 1. Во сколько раз изменится скорость прямой и 2S02(r) + 02(г) < ± 2S03(r) если объем газовой смеси уменьшится в три раза? В какую Решение. Обозначим концентрации реагирующих веществ:
152. На нейтрализацию 31 см3 0, 16 н. раствора щелочи требуется 217 см3 раствора H2S04? Чему равны молярная концентрация эквивалента и титр раствора H2S04? Ответ: 0, 023 н.; 1, 127- 10-3 г/см3. 153. Какой объем 0, 3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0, 32 г NaOH в 40 см3? Ответ: 26, 6 см3. 154. На нейтрализацию 1 л раствора, содержащего 1, 4 г КОН, требуется 50 см3 раствора кислоты. Вычислите молярную концентрацию эквивалента раствора кислоты. Ответ: 0, 5 н. 155. Какая масса HN03 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0, 4 н. раствора NaOH? Каков титр раствора NaOH? Ответ: 0, 882 г; 0, 016 г/см3. 156. Какую массу NaN03 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г. 157. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCI. Чему равна массовая доля полученного раствора: Ответ: 32, 5%. 158. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45, 72%. 159. Из 700 г 60%-иой серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Ответ: 84%. 160. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора? Ответ: 16, 7%.
Свойства растворов Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы. Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (Δ T) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением
165. Вычислите массовую долю (%) водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100, 39°С. Эбуллиоскопическая константа воды 0, 52°. Ответ: 6, 45%. 166. Вычислите молярную массу неэлектролита, зная, что раствор, содержащий 2, 25 г этого вещества в 250 г воды, кристаллизуется при - 0, 279 С. Крископическая константа воды 1, 86. Ответ: 60 г/моль. 167. Вычислите температуру кипения 5%-ного раствора нафталина C10H8 в бензоле. Температура кипения бензола 80, 2°С. Эбуллиоскопическая константа его 2, 57°. Ответ: 81, 25°С. 168. Раствор, содержащий 25, 65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0, 465 С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1, 86°. Ответ: 342 г/моль. 169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4, 25 г антрацена C14Н10 в 100 г уксусной кислоты, кристаллизуется при 15, 718 С. Температура кристаллизации уксусной кислоты 16, 65 С. Ответ: 3, 9. 170. При растворении 4, 86 г серы в 60 г бензола температура кипения его повысилась на 0, 81. Сколько атомов содержит молекула серы в этом растворе. Эбулиоскопическая константа бензола 2, 57. Ответ 8. 171. Температура кристаллизации раствора, содержащего 66, 3 г некоторого неэлектролита в 500 г воды, равна -0, 558°С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1, 86. Ответ: 442 г/моль. Какую массу анилина C6H5NH2 следует растворить в 50 гэтилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0, 53°. Эбулиоскопическая константа этилового эфира 2, 12°. Ответ: 1, 16 г. 173. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта С2Н5ОН. Криоскопическая константа воды 1, 86°, Ответ: 0, 82°С. 174. Сколько граммов мочевины (NН4)CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0, 465°? Криоскопическая константа воды 1, 86. Ответ: 1, 12 г. 175. Вычислите массовую долю (%) водного раствора глюкозы С6Н12О6, зная, что этот раствор кипит при 100/26 С. Эбулиоскопическая константа воды 0, 52°. Ответ: 8, 25%.
176. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1, 7°? Криоскопическая константа бензола 5, 1°. Ответ: 3, 91 г. 177. Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0, 26°? Эбулиоскопическая константа воды 0, 52°. Ответ: 7, 5 г. 178. При растворении 2, 3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0, 372°. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1, 86. Ответ: 92 г/моль. 179. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбулиоскопическая константа воды 0, 52°. Ответ: 101, 52°С. 180. Вычислите массовую долю (%) водного раствора метанола СН3ОН, температура кристаллизации которого -2, 79 С. Криоскопическая константа воды 1, 86°. Ответ: 4, 58%.
|

 Кинетика — учение о скорости различных процессов, в том
Кинетика — учение о скорости различных процессов, в том Но это неравенство не является полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так,
Но это неравенство не является полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так,