СПЕЦИАЛЬНЫЕ РАЗДЕЛЫ ХИМИИ 9 страница
Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль энергии Гиббса (Δ G), которая зависит от природы вещества, его количества и температуры. Энергия Гиббса является функцией состояния, поэтому
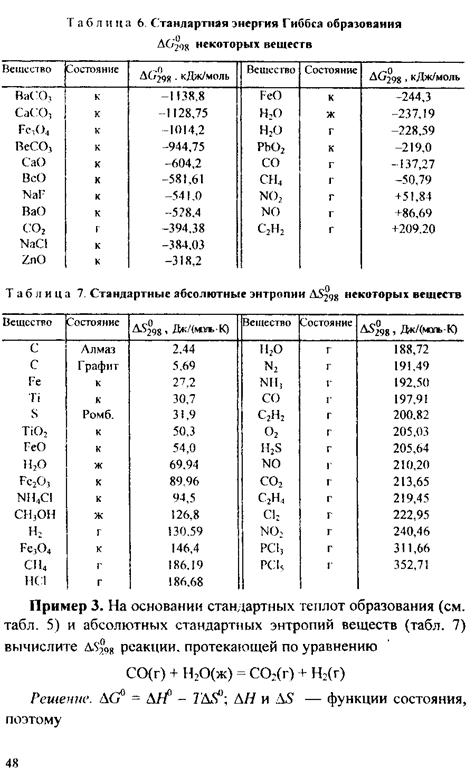
Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения Δ G. Если Δ G < 0, процесс принципиально осуществим; если Δ G > 0 процесс самопроизвольно проходить не может. Чем меньше AG, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором Δ G = 0 и АН = TΔ S. Из соотношения Δ G = Δ Н - TΔ S видно, что самопроизвольно могут протекать и процессы, для которых Δ Н> 0 (эндотермические). Это возможно, когда Δ S > О, но \ TΔ S\ > \Δ Н\ и тогда Δ G < 0. С другой стороны, экзотермические реакции (Δ Н < 0) самопроизвольно не протекают, если при Δ S < 0 окажется, что Δ G > 0. Пример 1. В каком состоянии энтропия 1 моль вещества больше при одинаковой температуре: в кристаллическом или парообразном? Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомна-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре. Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
соответствующих веществ приведены в табл. 6. Зная, что AG есть функция состояния и что Δ G для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим
|



 Решение. Вычислим
Решение. Вычислим  прямой реакции. Значения
прямой реакции. Значения процесса
процесса

 То, что, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном
То, что, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном