Хімічна кінетика і рівновага
Кінетика – навчання про швидкості різних процесів, у тому числі хімічних реакцій. Критерієм принципової здійсненності реакцій є нерівність Δ GT < 0. Але ця нерівність не є ще повною гарантією фактичного перебігу процесу в даних умовах, не є достатнім для оцінки кінетичних можливостей реакції. Так, Δ G0298(H2O)= –28, 59кДж/моль, а Δ G0298(AlI3) = –313, 8кДж/моль і, отже, при Т = 298K і P = 1, 013× 105 Па можливі реакції, що йдуть по рівнянням: H2(г)+ l/2O2(г) = H2O(г) (1) 2Al(к) + 3I2(к) = 2Al3(к) (2) Однак ці реакції при стандартних умовах йдуть тільки в присутності каталізатора (платини для першої і води для другої). Каталізатор як би знімає кінетичне „гальмо”, і тоді виявляється термодинамічна природа речовини. Швидкість хімічних реакцій залежить від багатьох факторів, основні з яких – концентрація (тиск) реагентів, температура і дія каталізатора. Ці ж фактори обумовлюють і досягнення рівноваги в реагуючій системі. Приклад 1. У скільки разів зміниться швидкість прямої і зворотної реакції в системі: 2SO2 (г) + O2(г) ↔ 2SO3(г), якщо об’єм газової суміші зменшити в три рази? В яку сторону зміститься рівновага системи? Рішення. Позначимо концентрації реагуючих речовин: [SO2] = а, [O2] = b, [SO3] = c. Відповідно до закону дії мас швидкості прямій (Vпр.) і зворотної (Vзв.) реакції до зміни об’єму: Vпр. = kпр.a2b; Vзв. = kзв.с2. Після зменшення об’єму гомогенної системи в три рази концентрація кожної з реагуючих речовин збільшиться в три рази: [SO2] =3а, [O2] = 3b, [SO3] = 3c. При нових концентраціях швидкості прямої і зворотної реакції: V пр.= kпр.(3a)2(3b) = 27 kпр.a2b; V зв. = kзв.(3с)2 = 9kзв.с2. Звідси:
Отже, швидкість прямої реакції збільшилася в 27 разів, а зворотної – тільки в дев’ять разів. Рівновага системи зміститься убік утворення SO3. Приклад 2. Обчислить, у скільки разів збільшиться швидкість реакції, що протікає в газовій фазі, при підвищенні температури від 30 до 70°С, якщо температурний коефіцієнт швидкості реакції дорівнює 2. Рішення. Залежність швидкості хімічної реакції від температури обумовлюється емпіричним правилом Вант-Гоффа по формулі:
Отже, швидкість реакції V(T2) – при температурі 70°C більше швидкості реакції V(T1)при температурі 30°С в 16 разів. Приклад 3. Константа рівноваги гомогенної системи: СО(г) + Н2О(г) ↔ СО2(г) + Н2(г) при 850°С дорівнює 1. Обчислить концентрації всіх речовин до моменту встановлення рівноваги, якщо вихідні концентрації: [СO]вих. = 3моль/дм3, [Н2O]вих. = 2моль/дм3. Рішення. При рівновазі швидкості прямій і зворотної реакцій рівні, а відношення констант цих швидкостей постійно і називається константою рівноваги даної системи: Vпр.=kпр.[CO] [H2O]; Vзв..= kзв. [CO2] [H2]; Vпр. = Vзв.; kпр..[CO] [H2O] = kзв. . [CO2] [H2];
В умові задачі дані вихідні концентрації, тоді як у вираз Kр входять тільки рівноважні концентрації всіх речовин системи. Припустимо, що до моменту рівноваги концентрації [CO2]р = x моль/дм3. Відповідно до рівняння системи число молей водню, що утворилося, при цьому буде також х моль/дм3. По стільки ж молей (моль/дм3) СО і H2О витрачається для утворення по х молей СО2 і Н2. Отже, рівноважні концентрації всіх чотирьох речовин: [CO2]р = [H] = х моль/дм3; [CO]р = (3–х) моль/дм3; [H2О]р = (2–х) моль/дм3 Знаючи константу рівноваги, знаходимо значення х, а потім вихідні концентрації всіх речовин: Таким чином, шукані рівноважні концентрації: [CO2]р = 1, 2 моль/дм3; [H]р =1, 2 моль/дм3; [CO]р = 3 – 1, 2 = 1, 8 моль/дм3; [H2О]р = 2 – 1, 2 = 0, 8 моль/дм3. Приклад 4. Ендотермічна реакція розкладання пентахлориду фосфору протікає по рівнянню: PCI5(г) ↔ PCI3(г) + CI2(г); Δ H = + 92, 59кДж. Як треба змінити: а) температуру; б) тиск; в) концентрацію, щоб змістити рівновагу убік прямої реакції – розкладання PCI5? Рішення. Зсувом або зміщенням хімічної рівноваги називають зміну рівноважних концентрацій реагуючих речовин у результаті зміни однієї з умов реакції. Напрямок, у якому змістилася рівновага, визначається за принципом Ле Шателье: а) оскільки реакція розкладання PCI5 ендотермічна, то для зсуву рівноваги убік прямої реакції потрібно підвищити температуру; б) оскільки в даній системі розкладання PCI5 веде до збільшення об’єму (з однієї молекули газу утворяться дві газоподібні молекули) то для зсуву рівноваги убік прямої реакції треба зменшити тиск; в) зсуву рівноваги в зазначеному напрямку можна досягти як збільшенням концентрації PCI5, так і зменшенням концентрації PCI3 або Cl2. Контрольні питання 121. Окислювання сірки і її діоксиду протікає за рівняннями: а) S(к) + О2 = SO2(г); б) 2SO2(г) + О2 = 2SO3(г). Як зміняться швидкості цих реакцій, якщо об’єми кожної із систем зменшити в чотири рази? 122. Напишіть вираз для константи рівноваги гомогенної системи: N2 +3H2 = 2NH3. Як зміниться швидкість прямої реакції – утворення аміаку, якщо збільшити концентрацію водню в три рази? 123. Реакція йде по рівнянню: N2 + O2 = 2NO. Концентрації вихідних речовин до початку реакції були: [N2]вих. = 0, 049 моль/дм3; [О2]вих. = 0, 01 моль/дм3. Обчислить концентрацію цих речовин у момент, коли [NO] = 0, 005 моль/дм3. Відповідь: [N2] = 0, 0465 моль/дм3; [О2] = 0, 0075 моль/дм3. 124. Реакція йде по рівнянню: N2 + 3Н2 = 2NН3. Концентрації речовин, що беруть участь у ній, були: [N2] = 0, 80 моль/дм3; [Н2] = 1, 5 моль/дм3; [NH3] = 0, 10 моль/дм3. Обчислить концентрацію водню й аміаку, коли [N2] = 0, 5 моль/дм3. Відповідь: [NН3] = 0, 70 моль/дм3; [Н2] = 0, 60 моль/дм3. 125. Реакція йде по рівнянню: Н2 + I2 = 2HI. Константа швидкості цієї реакції при деякій температурі дорівнює 0, 16. Вихідні концентрації реагуючих речовин: [Н2]ВИХ. = 0, 04 моль/дм3; [I2]ВИХ. = 0, 05 моль/дм3. Обчислить початкову швидкість реакції і її швидкість, коли [Н2] = 0, 03 моль/дм3. Відповідь: 3, 2× 10–4; 1, 92× 10–4. 126. Обчислить, у скільки разів зменшиться швидкість реакції, що протікає в газовій фазі, якщо понизити температуру від 120 до 80°С. Температурний коефіцієнт швидкості реакції 3. 127. Як зміниться швидкість реакції, що протікає в газовій фазі, при підвищенні температури на 60°С, якщо температурний коефіцієнт швидкості даної реакції 2? 128. В гомогенній системі: СО + Cl2 = COCl2 рівноважні концентрації реагуючих речовин: [СО] = 0, 2 моль/дм3; [Cl2] = 0, 3 моль/дм3; [COCl2] = 1, 2 моль/дм3. Обчислить константу рівноваги системи і вихідні концентрації хлору і СО. Відповідь K = 20; [Cl2]вих. = 1, 5моль/дм3; [CО]вих. = 1, 4 моль/дм3. 129. В гомогенній системі: A + 2B = C рівноважні концентрації реагуючих газів: [A] = 0, 06 моль/дм3; [B] = 0, 12 моль/дм3; [C] = 0, 216 моль/дм3. Обчислить константу рівноваги системи і вихідні концентрації речовин A і B. Відповідь: K = 250; [A]вих. = 0, 276 моль/дм3; [B]вих. = 0, 552 моль/дм3. 130. В гомогенній системі: A + B = C + D рівновага установилася при концентраціях: [B] = 0, 05 моль/дм3; [C] = 0, 02 моль/дм3. Константа рівноваги системи дорівнює 0, 04. Обчислить вихідні концентрації речовин A і B. Відповідь: [A]вих. = 0, 22 моль/дм3; [B]вих. = 0, 07 моль/дм3. 131. Константа швидкості реакції розкладання N2O, що протікає по рівнянню: 2N2O = 2N2 + O2, дорівнює 5× 10–4. Початкова концентрація N2O = 6, 0 моль/дм3. Обчислить початкову швидкість реакції і її швидкість, коли розкладеться 50% N2O. Відповідь: 1, 8× 10–2; 4, 5× 10 –3. 132. Напишіть вираз для константи рівноваги гетерогенної системи: СО2 + С = 2СО. Як зміниться швидкість прямої реакції – утворення СО, якщо концентрацію СО2 зменшити в чотири рази? Як треба змінити тиск, щоб підвищити вихід СО? 133. Напишіть вираз для константи рівноваги гетерогенної системи: С(к) + Н2О(г) = СО(г) + Н2(г). Як треба змінити концентрацію і тиск, щоб змістити рівновагу убік зворотної реакції – утворення водяної пари? 134. Рівновага в гомогенній системі: 4HCl(г) + О2(г) = 2Н2О(г) + 2Cl2(г) установилася при наступних концентраціях реагуючих речовин: [Н2О] = 0, 14 моль/дм3; [Cl2] = 0, 14 моль/дм3; [HCl] = 0, 20 моль/дм3; [O2] =0, 32 моль/дм3. Обчислить вихідні концентрації хлороводню і кисню. Відповідь: [HCl]вих. = 0, 48 моль/дм3 [О2]вих. = 0, 39 моль/дм3. 135. Обчислить константу рівноваги для гомогенної системи: СО(г) + Н2О(г) = СО2(г) + Н2(г), якщо рівноважні концентрації реагуючих речовин: [СО] = 0, 004 моль/дм3; [Н2О] = 0, 064 моль/дм3; [СО2] = 0, 016 моль/дм3; [Н2] = 0, 016 моль/дм3. Чому дорівнюють вихідні концентрації води і СО? Відповідь: K = 1; [Н2О]вих. = 0, 08 моль/дм3; [СО]вих. = 0, 02 моль/дм3. 136. Константа рівноваги гомогенної системи: СО(г) + Н2О(г) = СО2(г) + Н2(г) при деякій температурі дорівнює 1. Обчислить рівноважні концентрації всіх реагуючих речовин, якщо вихідні концентрації: [СО]вих. = 0, 10 моль/дм3; [Н2О]вих. = 0, 40 моль/дм3. Відповідь: [СО2] = [Н2] = 0, 08 моль/дм3; [СО] = 0, 02 моль/дм3; [Н2O] = 0, 32 моль/дм3. 137. Константа рівноваги гомогенної системи: N2(г) + 3H2(г) = 2NH3(г) при деякій температурі дорівнює 0, 1. Рівноважні концентрації водню й аміаку відповідно рівні 0, 2 і 0, 08 моль/дм3. Обчислить рівноважну і вихідну концентрацію азоту. Відповідь: [N2] = 8 моль/дм3; [N2]вих. = 8, 04 моль/дм3. 138. При деякій температурі рівновага гомогенної системи: 2NO(г) + O2(г)= 2NO2(г) встановилася при наступних концентраціях реагуючих речовин: [NO] = 0, 2 моль/дм3; [О2] = 0, 1 моль/дм3; [NO2] = 0, 1 моль/дм3. Обчислить константу рівноваги і вихідну концентрацію NO і O2. Відповідь: K = 2, 5; [NO]ВИХ. = 0, 3 моль/дм3; [О2]вих. = 0, 15 моль/дм3. 139. Чому при зміні тиску зміщується рівновага системи: N2(г) + 3H2(г)= 2NH3(г) і не зміщається рівновага системи: N2(г) + O2(г) = 2NO(г)? Відповідь мотивуйте на основі розрахунку швидкості прямій і зворотної реакції в цих системах до, і після зміни тиску. Напишіть вираз для констант рівноваги кожної з даних систем. 140. Вихідні концентрації [NO]вих. і [Cl2]вих. у гомогенній системі: 2NO(г) + Cl2(г) = 2NOCl(г) становлять відповідно 0, 5 і 0, 2 моль/дм3. Обчислить константу рівноваги, якщо до моменту настання рівноваги прореагувало 20% NO. Відповідь: 0, 417.
|

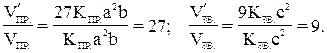
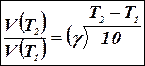
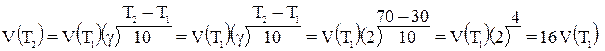
 .
.



