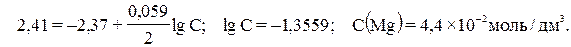Стандартні електродні потенціали (E0) деяких металів, B
Приклад 2. Магнієву пластинку занурили в розчин його солі. При цьому електродний потенціал магнію дорівнює –2, 41В. Обчислить концентрацію іонів магнію (моль/дм3). Рішення. Подібні задачі також вирішуються на основі рівняння Нернста (див. приклад 1): Приклад 3. Складіть схему гальванічного елемента, у якому електродами є магнієва і цинкова пластинки, занурені в розчини їхніх іонів з концентрацією 1 моль/дм3. Який метал є анодом, який катодом? Напишіть рівняння окислювально–відновної реакції, що протікає в цьому гальванічному елементі, і обчислить його ЕРС. Рішення. Схема даного гальванічного елемента: Анод (−) Mg | Mg2+ || Zn2+ |Zn (+) Катод Вертикальна лінія позначає поверхню розділу між металом і розчином, а дві лінії – границю розділу двох рідких фаз – пористу перегородку (або сполучну трубку, заповнену розчином електроліту). Магній має менший потенціал (–2, 37В) і є анодом, на якому протікає окисний процес: (А) Mg0 – 2e− = Mg2+ Цинк, потенціал якого –0, 763В, – катод, тобто електрод, на якому протікає відновний процес: (K) Zn2+ + 2e− = Zn0 Рівняння окислювально-відновної реакції, що характеризує роботу даного гальванічного елемента, можна одержати, склавши електронні рівняння анодного і катодного процесів: Mg0 + Zn2+ = Mg2+ + Zn0 Для визначення ЕРС гальванічного елемента з потенціалу катода треба відняти потенціал анода. Оскільки концентрація іонів у розчинах дорівнює 1 моль/дм3, то ЕРС елемента дорівнює різниці стандартних потенціалів двох його електродів: ЕРС = Е(K) – Е(A) = Е0(Zn) – Е0(Mg) = –0, 763 – (–2, 37) = 1, 607В. Контрольні питання 241.В дві посудини з блакитним розчином мідного купоросу помістили в перший цинкову пластинку, а в другий – пластинку зі срібла. В якій посудині колір розчину поступово пропадає? Чому? Складіть електронне і молекулярне рівняння відповідної реакції. 242. Збільшиться, зменшиться або залишиться незмінною маса цинкової пластинки при взаємодії її з розчинами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Чому? Складіть електронні і молекулярні рівняння відповідних реакцій. 243. При якій концентрації іонів Zn2+ (у моль/дм3) потенціал цинкового електрода буде на 0, 015В менше його стандартного електродного потенціалу? Відповідь: 0, 31 моль/дм3. 244. Збільшиться, зменшиться або залишиться незмінною маса кадмієвої пластинки при взаємодії її з розчинами: а) AgNO3; б) ZnSO4; в) NiSO4? Чому? Складіть електронні і молекулярні рівняння відповідних реакцій. 245. Марганцевий електрод у розчині його солі має потенціал –1, 23В. Обчислить концентрацію іонів Mn2+(у моль/дм3). Відповідь: 2× 10–2 моль/дм3. 246. Потенціал срібного електрода в розчині AgNO3 склав 95% від значення його стандартного електродного потенціалу. Чому дорівнює концентрація іонів Ag+ (у моль/дм3)? Відповідь: 0, 21 моль/дм3. 247. Складіть схему, напишіть електронні рівняння електродних процесів і обчислить ЕРС мідь-кадміевого гальванічного елемента, у якому [Cd2+]=0, 8 моль/дм3, а [Cu2+]=0, 01 моль/дм3. Відповідь: 0, 687В. 248. Складіть схеми двох гальванічних елементів, в одному з яких мідь був би катодом, а в іншому – анодом. Напишіть для кожного з цих елементів електронні рівняння реакцій, що протікають на катоді й аноді. 249. При якій концентрації іонів Cu2+(у моль/дм3) значення потенціалу мідного електрода стає рівним стандартному потенціалу водневого електрода? Відповідь: 2, 985× 10–12 моль/дм3. 250. Який гальванічний елемент називається концентраційним? Складіть схему, напишіть електронні рівняння електродних процесів і обчислить ЕРС гальванічного елемента, що складається з пластин срібла, занурених: перша у розчин AgNO3 з концентрацією 0, 01моль/дм3, а друга у розчин AgNO3 з концентрацією 0, 1 моль/дм3. Відповідь: 0, 059В. 251. При якій умові буде працювати гальванічний елемент, електроди якого зроблені з одного металу? Складіть схему, напишіть електронні рівняння електродних процесів і обчислить ЕРС гальванічного елемента, у якому один нікельовий електрод знаходиться в розчині хлориду нікелю з концентрацією 0, 001 моль/дм3, а інший такий же електрод – у розчині сульфату нікелю з концентрацією 0, 01 моль/дм3. Відповідь: 0, 0295 В. 252. Складіть схему, напишіть електронні рівняння електродних процесів і обчислить ЕРС гальванічного елемента, що складається із пластин свінцю та магнію, занурених у розчини своїх солей з концентрацією [Pb2+] = [Mg2+] = 0, 01 моль/дм3. Чи зміниться ЕРС цього елемента, якщо концентрацію кожного з іонів збільшити в однакове число разів? Відповідь: 2, 244 В. 253. Складіть схеми двох гальванічних елементів, в одному з яких нікель є катодом, а в іншому – анодом. Напишіть для кожного з цих елементів електронні рівняння реакцій, що протікають на катоді й аноді. 254.Залізна і срібна пластини з’єднані зовнішнім провідником і занурені в розчин сульфатної кислоти. Складіть схему даного гальванічного елемента і напишіть електронні рівняння процесів, що відбуваються на аноді і катоді. 255. Складіть схему, напишіть електронні рівняння електродних процесів і обчислить ЕРС гальванічного елемента, що складається з пластин кадмію і магнію, занурених у розчини своїх солей з концентрацією [Mg2+] = [Cd2+] = 1 моль/дм3. Чи зміниться значення ЕРС, якщо концентрацію кожного з іонів понизити до 0, 01 моль/дм3? Відповідь: 1, 967 В. 256. Складіть схему гальванічного елемента, що складається з пластин цинку і заліза, занурених у розчини їхніх солей. Напишіть електронні рівняння реакцій, що протікають на катоді й аноді. Якої концентрації треба було б взяти розчин заліза (моль/дм3), щоб ЕРС елемента стала рівною нулю, якщо [Zn2+] = 0, 001 моль/дм3? Відповідь: 1, 12× 10–14 моль/дм3. 257. Складіть схему гальванічного елемента, в основі якого лежить реакція, що протікає по рівнянню: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Напишіть електронні рівняння анодного і катодного процесів. Обчислить ЕРС цього елемента, якщо [Ni2+] = 0, 01 моль/дм3, [Pb2+] = 0, 0001 моль/дм3. Відповідь: 0, 064 В. 258. Які хімічні процеси протікають на електродах при зарядці і розрядці свинцевого акумулятора? 259. Які хімічні процеси протікають на електродах при зарядці і розрядці нікель–кадмієвого акумулятора? 260. Які хімічні процеси протікають на електродах при зарядці і розрядці залізо–нікельового акумулятора?
|