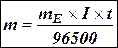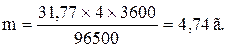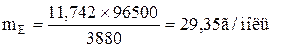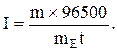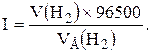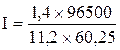Електроліз
Приклад 1. Яка маса міді виділиться на катоді при електролізі розчину CuSO4 на протязі 1 години при силі струму 4А? Рішення. Відповідно до законів Фарадея: де m – маса речовини, окисленої або відновленої на електроді; mE – маса еквіваленту речовини; I – сила струму, A; t – тривалість електролізу, с. Маса еквіваленту міді в CuSO4 дорівнює 63, 54/2 = 31, 77г/моль. Підставивши в рівняння Фарадея значення mЕ = 31, 77, I = 4А, t = 60× 60 = 3600с, одержимо: Приклад 2. Обчислить масу еквіваленту металу, знаючи, що при електролізі розчину хлориду цього металу витрачено 3880Кл електрики і на катоді виділяється 11, 742г металу. Рішення. З рівняння Фарадея випливає: де: m = 11, 742г; I × t = Q = 3880Кл. Приклад 3. Чому дорівнює сила струму при електролізі розчину на протязі 1год. 40хв. 25с, якщо на катоді виділилося 1, 4дм3 водню (н.у.)? Рішення. З рівняння Фарадея випливає: З приводу того, що дано об’єм водню, відношення m/mЕ заміняємо відношенням V(H2)/ VЕ(H2), де V(H2) – об’єм водню, VЕ(H2) – об’єм еквіваленту водню, дм3. Тоді: Об’єм еквіваленту водню при н.у. дорівнює половині молярного обєму 22, 4/2 =11, 2дм3. Підставивши в приведену формулу значення V(H2) = 1, 4дм3, VЕ(H2) = 11, 2дм3, t = 6025с (1год. 40хв. 25с = 6025с), знаходимо: Приклад 4. Яка маса гідроксиду калію утворилася на катоді при електролізі розчину K2SO4, якщо на аноді виділилося 11, 2дм3 кисню (н.у.)? Рішення. Об’єм еквіваленту кисню (н.у.) 22, 4/4 = 5, 6дм3. Отже, 11, 2дм3 містять дві маси еквіваленту кисню. Стільки ж мас еквіваленту KОН утворилося на катоді, або 56, 11× 2 = 112, 22 г (56, 11г/моль – мольна й маса еквіваленту KОН). Контрольні питання 261. Електроліз розчину K2SO4 проводили при силі струму 5А на протязі 3год. Складіть електронні рівняння процесів, що відбуваються на електродах. Яка маса води при цьому розклалася і чому дорівнюють об’єми газів (н.у.), що виділилися на катоді й аноді? Відповідь: 15, 105г; 6, 266дм3; 3, 133дм3. 262. При електролізі солі деякого металу на протязі 1, 5год. при силі струму 1, 8А на катоді виділилося 1, 75г цього металу. Обчислить молярну масу еквіваленту цього металу. Відповідь: 1, 74г/моль. 263. При електролізі розчину CuSO4 на аноді виділилося 168см3 газу (н.у.). Складіть електронні рівняння процесів, що відбуваються на електродах, і обчислить, яка маса міді виділилася на катоді. Відповідь: 0, 953г. 264. Електроліз розчину Na2SO4 проводили на протязі 5год. при силі струму 7А. Складіть електронні рівняння процесів, що відбуваються на електродах. Яка маса води при цьому розклалася і чому дорівнює об’єм газів (н.у.), що виділилися на катоді й аноді? Відповідь: 35, 25г; 14, 62дм3; 7, 31дм3. 265. Електроліз розчину нітрату срібла проводили при силі струму 2А на протязі 4год. Складіть електронні рівняння процесів, що відбувалися на електродах. Яка маса срібла виділилася на катоді і який об’єм газу (н.у.), виділився на аноді? Відповідь: 32, 20г; 1, 67дм3. 266. Електроліз розчину сульфату деякого металу проводили при силі струму 6А на протязі 45хв., в результаті чого на катоді виділилося 5, 49г металу. Обчислить молярну масу еквіваленту цього металу. Відповідь: 32, 7г/моль. 267. Наскільки зменшиться маса анода зі срібла, якщо електроліз розчину AgNO3 проводили при силі струму 2А на протязі 38хв. 20с? Складіть електронні рівняння процесів, що відбуваються на графітових електродах. Відповідь: 5, 14г. 268. Електроліз розчину сульфату цинку проводили на протязі 5год., в результаті чого виділилося 6дм3 кисню (н.у.). Складіть рівняння електродних процесів і обчислить силу струму. Відповідь: 5, 74А. 269. Електроліз розчину CuSO4 проводили з мідним анодом на протязі 4год. при силі струму 50А. При цьому виділилося 224г міді. Обчислить вихід по струму (відношення маси речовини, що виділилося, до теоретично можливого). Складіть електронні рівняння процесів, що відбуваються на електродах у випадку мідного і вугільного анода. Відповідь: 94, 48%. 270. Електроліз розчину NaI проводили при силі струму 6А на протязі 2, 5год. Складіть електронні рівняння процесів, що відбуваються на вугільних електродах, і обчислить масу речовин, що виділились на катоді й аноді. Відповідь: 0, 56г; 71, 0г. 271. Складіть електронні рівняння процесів, що відбуваються на вугільних електродах при електролізі розчину AgNO3. Якщо електроліз проводити з анодом зі срібла, то його маса зменшується на 5, 4г. Визначте витрату електрики при цьому. Відповідь: 4830Кл. 272. Електроліз розчину CuSO4 проводили на протязі 15хв., при силі струму 2, 5А. Виділилося 0, 72г міді. Складіть електронні рівняння процесів, що відбуваються на електродах у випадку мідного і вугільного анода. Обчислить вихід по струму (відношення маси речовини, що виділилося, до теоретично можливого). Відповідь: 97, 3%. 273. Складіть електронні рівняння процесів, що відбуваються на графітових електродах при електролізі розплавів і водних розчинів NaCl і KOH. Скільки літрів (н.у.) газу виділиться на аноді при електролізі гідроксиду калію, якщо електроліз проводити на протязі 30хв. при силі струму 0, 5А? Відповідь: 0, 052дм3. 274. Складіть електронні рівняння процесів, що відбуваються на графітових електродах при електролізі розчину KBr. Яка маса речовини виділяється на катоді й аноді, якщо електроліз проводити на протязі 1год. 35хв. при силі струму 15А? Відповідь: 0, 886г; 70, 79г. 275. Складіть електронні рівняння процесів, що відбуваються на вугільних електродах при електролізі розчину CuCl2. Обчислить масу міді, що виділилася на катоді, якщо на аноді виділилося 560см3 газу (н.у.). Відповідь: 1, 588г. 276. При електролізі солі тривалентного металу при силі струму 1, 5А на протязі 30хв. на катоді виділилося 1, 071г металу. Обчислить атомну масу металу. Відповідь: 114, 82 а.о.м. 277. При електролізі розчинів MgSO4 і ZnCl2, з’єднаних послідовно з джерелом струму, на одному з катодів виділилося 0, 25г водню. Яка маса речовини виділиться на іншому катоді; на анодах? Відповідь: 8, 17г; 2, 0г; 8, 86г. 278. Складіть електронні рівняння процесів, що відбуваються на вугільних електродах при електролізі розчину Na2SO4. Обчислить масу речовини, що виділяється на катоді, якщо на аноді виділяється 1, 12дм3 газу (н.у.). Яка маса H2SO4 утвориться при цьому біля анода? Відповідь: 0, 2г; 9, 8г. 279. При електролізі розчину солі кадмію витрачено 3434Кл електрики. Виділилося 2г кадмію. Чому дорівнює молярна маса еквіваленту кадмію? Відповідь: 56, 26г/моль. 280. Складіть електронні рівняння процесів, що відбуваються на електродах при електролізі розчину KOH. Чому дорівнює сила струму, якщо на протязі 1год. 15хв. 20с на аноді виділилося 6, 4г газу? Скільки літрів газу (н.у.) виділилося при цьому на катоді? Відповідь: 17, 08А; 8, 96дм3.
|