Закон термического равновесия
Для одноатомных газов кинетическая энергия есть энергия поступательного движения. Из классической механики известно, что энергия поступательного движения частицы определяется её скоростью и массой.
где m – усредненная масса и u – средняя скорость движения атомов. Из статистической физики следует, что средняя кинетическая энергия частицы, обладающей только поступательным движением, прямо пропорциональна свойству системы – температуре Т.
где k – постоянная Больцмана; T – абсолютная температура. Совместное решение уравнений (4.1) и (4.2) приводит к выражению абсолютной температуры как величины, прямо пропорциональной средней кинетической энергии микрочастиц системы
Для таких объектов, как атомы, например атомы инертных (благородных) газов, температура определяется энергией поступательного движения. В случае многоатомных молекул кинетическая энергия включает энергию различных видов движения. Представим модель трехатомной молекулы в виде шариков, связанных пружинками. Для такой молекулы характерна энергия поступательного, колебательного движения атомов в молекуле, а также вращательного и деформационного движения (рис. 33). Е кин. = Е пост. + Е колеб. + Е вращ. + Е деформ.
Рис. 33. Формы движения трехатомной молекулы
Для системы, состоящей из громадного числа микрочастиц разной массы и совершающих разнообразные движения, а не только поступательное движение, температура системы является отражением всех форм движения частиц и абсолютная температура системы Т определяется средней кинетической энергией микрочастиц. Рассмотрим построение термометрической шкалы на примере расширения – сжатия газа. Для идеального газа характерны два свойства: 1) объем молекул газа, много меньше объема, занятого всем газом; 2) радиус взаимодействия двух молекул значительно меньше среднего расстояния между ними. Идеальных газов как таковых не существует, но можно взять инертный газ или молекулярный азот. Они с успехом выполняют функцию идеального газа. Заполним газом сосуд постоянного объема (V = const). Измерим давление газа (р 2) в сосуде при температуре кипящей воды (Т 2) и давление газа (р 1) при температуре таящего льда (Т 1). При постоянном атмосферном давлении (р = 1 атм) эксперимент всегда дает одно и то же отношение давлений газа в кипящей воде и плавящемся льду:
Сделаем первое допущение, примем, что отношение давлений прямо пропорционально отношению температур
тогда Введем второе допущение, примем, что разность температур Т 1 и Т 2 равна 100 Т 2 – Т 1 = 100. (4.5) Совместное решение уравнений (4.4) и (4.5) позволяет установить численное значение температуры кипения воды и плавления льда по так называемой абсолютной шкале температур. Температура кипения воды Т 2 = 373.15 К, а температура плавления льда Т 1 = 273.15 К. Абсолютная шкала температур всегда положительна. Она введена английским физиком У. Томсоном (лордом Кельвином). Закон термического равновесия утверждает, что две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом (рис. 34).
Рис. 34. Термическое равновесие между телами. Если Т 1 = Т 3 и Т 2 = Т 3, то Т 1 = Т 2
|

 , (4.1)
, (4.1) , (4.2)
, (4.2)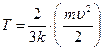 . (4.3)
. (4.3)
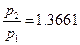 .
.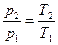 ,
,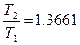 . (4.4)
. (4.4)



