Кристаллы
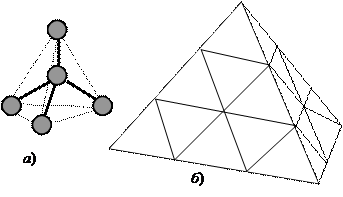
Кристаллы с ковалентными связями представляют собой структуры химически связанных атомов. Примером кристалла с ковалентными связями может служить алмаз (рис. 21). Кристаллическая решетка алмаза гранецентрированная кубическая. Кристаллы обычно имеют форму октаэдра, ромбододекаэдра, куба или тетраэдра.
Рис. 21. Модель структуры кристалла алмаза: а) фрагмент кристаллической решетки: центральный атом углерода окружен четырьмя равноудаленными атомами углерода, находящимися в углах тетраэдра; б) кристалл, построенный из тетраэдрических фрагментов
Кристаллы с ионными связями – это твердые тела, состоящие из химически связанных положительно и отрицательно заряженных ионов. Их кристаллическая решетка построена так, что силы электростатического притяжения и отталкивания разноименно и одноименно заряженных ионов уравновешены. Ионную кристаллическую решетку имеют соли, оксиды металлов, основания, комплексные соединения. Структура кристаллической решетки зависит от размеров и природы катионов и анионов. Например, на рис. 22 представлена кубическая кристаллическая решетка хлорида натрия.
Рис. 22. Модель ионной кристаллической решетки хлорида натрия. Пунктирные линии приведены для того, чтобы показать объемность кристалла
Молекулярные кристаллы содержат в узлах кристаллической решетки молекулы, которые удерживаются между собой силами электростатического притяжения. Например, такую кристаллическую решетку образуют диполи молекулы воды (рис. 23). Диполь – совокупность двух равных по величине разноименных зарядов (d), находящихся на некотором расстоянии (l) друг от друга. Заметим, что d указывает на долю от целого заряда, которая приходится на участок электронейтральной молекулы. Диполи воды располагаются в кристалле льда (рис. 24) в виде прочной тетраэдрической кристаллической решетки. Центры тяжести положительных и отрицательных зарядов в молекулах не совпадают.
 рис. 25. рис. 25.
  

 
Рис. 23. Модели молекулы воды: а) атом кислорода в молекуле воды находится в sp3 гибридном состоянии; б) диполь
Рис. 24. Фрагмент кристалла льда
Дипольный момент m такой молекулы вычисляется по уравнению m = δ × l, где δ – величина заряда; l – расстояние между центрами тяжести положительного и отрицательного зарядов молекулы (рис.23 б). Один из способов объяснения природы металлической связи основывается на представлении об электронном газе. Кристаллы с металлическими связями представляют собой упорядоченные структуры положительно заряженных ионов, удерживающихся в кристаллической решетке подвижными электронами («электронным газом») (рис.17). При ударе металл не раскалывается подобно льду, алмазу или кристаллу соли, а лишь изменяет форму. Электроны благодаря своей подвижности успевают в момент удара переместиться и удержать ионы в новом положении. Именно поэтому металлы ковки и пластичны, легко изгибаются без разрушения. Кристаллическая решетка металла становится хрупкой только при очень низкой температуре, например при температуре жидкого азота (- 210 0С). Связано это с появлением некоторой доли ковалентно связанных атомов металла (рис. 25).
Рис. 25. Модель кристаллической решетки металла с некоторой долей ковалентных связей. Точками обозначены электроны
Модели возможных типов кристаллических решеток представлены на рис. 26.
Рис. 26. Модели кристаллических решеток (показана одна плоскость объемного кристалла): а) ковалентная или атомная; б) ионная; в) молекулярная; г) металлическая
|