Квантовые правила образования химических
Связей Для характеристики трех типов химических связей – ковалентной, ионной и металлической используются методы валентных связей (ВС) и молекулярных орбиталей (МО). На заре использования квантовой механики в химии (В. Гейтлер и Ф. Лондон, 1927 г.) было доказано, что волновое уравнение (его называют уравнением Шредингера) справедливо для описания как свойств атомов, так и молекул. В молекулах, ионных соединениях и металлах действуют электрические силы притяжения и отталкивания, которые взаимно уравновешены и обеспечивают их устойчивость. Теоретические расчеты квантовой механики позволили сформулировать следующие положения метода валентных связей:
В методе, предложенном Гейтлером и Лондоном, образование химической связи рассматривается как результат перекрывания атомных орбиталей (АО), заселенных электронами с противоположными спинами. Но это не единственный подход к объяснению химической связи. Существует метод молекулярных орбиталей (МО). Он основан на допущении, что электроны, участвующие в образовании химической связи, образуют молекулярные орбитали, как в атоме атомные орбитали. Принцип запрета Паули, правило Гунда, принцип наименьшей энергии (правило Клечковского) справедливы и для молекулярных орбиталей. Основы метода МО разработаны Р. Малликеном и Ф. Гундом в 1928-1930 гг. и сводятся к следующим положениям: 1. молекула - это единая система ядер и электронов, а не совокупность атомов, сохраняющих некоторую индивидуальность; 2. электроны в молекулах располагаются на молекулярных орбиталях (МО); 3. число образовавшихся связывающих и разрыхляющих МО равно числу АО исходных атомов; 4. устойчивость молекулы определяется разностью числа электронов на связывающих и разрыхляющих орбиталях. Эта разность выражает порядок связи. Для описания электронного состояния молекулы в методе МО используются энергетические диаграммы, аналогичные диаграммам энергетических уровней в атомах. Если в поле ядер двухатомной молекулы, например молекулы водорода, электроны движутся так, что «мешают» друг другу (отталкиваются), образуется разрыхляющая молекулярная орбиталь. Разрыхляющая орбиталь препятствует образованию химической связи и располагается на более высоком энергетическом уровне по сравнению с энергетическими уровнями атомных орбиталей. Если два электрона движутся в поле ядер так, что они «помогают» друг другу удерживать ядра на расстоянии длины химической связи, образуется связывающая молекулярная орбиталь. Она обеспечивает образование химической связи, располагаясь на более низком энергетическом уровне по сравнению с энергетическими уровнями атомных орбиталей. Продемонстрируем применение метода МО на примере двухатомных молекул. В молекуле Н2 атомы Н теряют свою индивидуальность. Два электрона, расположенные на атомных орбиталях, заполняют лишь связывающую s1 s молекулярную орбиталь, разрыхляющая s*1 s молекулярная орбиталь остается незаполненной (рис. 18).
Рис. 18. Энергетическая диаграмма молекулы водорода: s1 s -связывающая молекулярная орбиталь, s*1 s -разрыхляющая молекулярная орбиталь
Последовательность заполнения s1 s и s*1s молекулярных орбиталей электронами происходит в соответствии с квантовыми правилами: от низших к высшим энергетическим уровням при соблюдении принципа запрета Паули и правила Гунда. Устойчивость молекулярного образования оценивается по значению порядка связи. Порядок связи (W) - это число, равное разности между количеством электронов на связывающих и разрыхляющих орбиталях, поделенное на 2.
В молекуле водорода порядок связи равен 1. Чем больше порядок связи, тем устойчивее молекула. Если порядок связи равен нулю, это означает, что химическое связывание атомов невозможно. Молекула Не2 не существует. Порядок связи в такой молекуле равен 0 (рис. 19).
Рис. 19. Энергетическая диаграмма, подтверждающая, что гипотетическая двухатомная молекула гелия Не2 не существует
В молекуле кислорода порядок связи равен 2.
Рис. 20 свидетельствует о более высокой прочности химического связывания атомов в молекуле кислорода по сравнению с молекулой водорода.
Рис. 20 Энергетическая диаграмма молекулы кислорода; разрыхляющие молекулярные орбитали помечены звездочкой
|



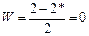



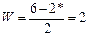 .
.



