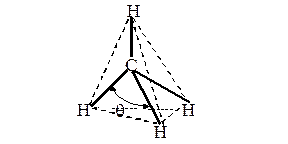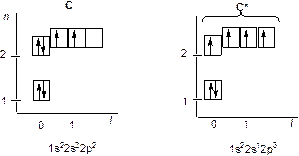Гибридизация, s- и p-связи
На рис. 9 представлена молекула метана СН4 с ковалентными s-связями. Ковалентная s-связь образуется между атомами при перекрывании орбиталей вдоль линии, проходящей через ядра атомов. Рассмотрим структуру пятиатомной молекулы метана СН4. Четыре ковалентных связи (темные линии) расположены в пространстве симметрично (рис. 9). Если атом углерода поместить в центре тетраэдра, то химические связи, соединяющие атом углерода с атомами водорода, направленны к его вершинам. Как могли образоваться четыре равноценные связи в метане при наличии в атоме углерода двух электронов, расположенных на 2 р -орбиталях, напоминающих по форме спортивные гантели, и двух электронов на сферической 2 s -орбитали? Это возможно, если атом углерода переходит из основного 1s22 s 22 p 2 в возбужденное состояние 1s22 s 12 p 3, перестраивая внешние электронные оболочки (рис. 10). На рис. 11 показано sp3 гибридное состояние атома углерода в молекуле метана.
Рис. 9. Модель молекулы метана. Угол q между С—Н связями составляет 109.280
Рис. 10. Распределение электронов по энергетическим уровням (квантовым ячейкам) в атоме углерода: основное состояние С и возбужденное состояние С*
Гибридизация представляет собой способ описания перестройки атомных орбиталей в молекуле по сравнению со свободным атомом. Эта идея принадлежит выдающимся физикам Л. Полингу и Д. Слэтеру.
   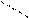  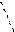 
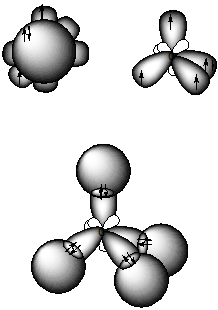
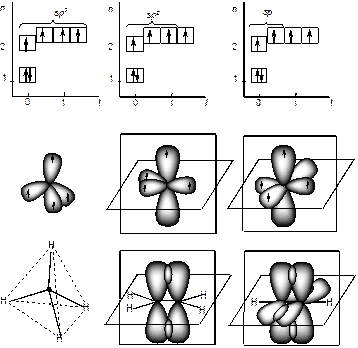
Рис. 11. Состояние атома углерода(sp3 гибридизация) в молекуле метана
Гибридизация позволяет объяснить существование не только одинарных, но двойных и тройных связей между атомами. В молекуле метана (рис. 11 и 12 а) sp3 -гибридизация атома углерода обеспечивает расположение ковалентных s-связей под углом 109.280. В молекуле этилена атом углерода существует в sp2 гибридном состоянии. Три sp2 -гибридные орбитали углерода расположены в одной плоскости под углом 1200 и одна р -орбиталь перпендикулярна плоскости. В молекуле этилена Н2С=СН2 между атомами углерода образуется двойная связь: одна – s (сигма) -связь, вторая – p (пи) -связь (рис. 12, б). p -Связь между атомами осуществляется таким образом, что образуются две области перекрывания р-орбиталей по обе стороны от оси s-связи. В молекуле ацетилена НС≡ СН, имеющей тройную химическую связь, атомы углерода находятся в состоянии sр -гибридизации. В атомах углерода ацетилена существуют две взаимно перпендикулярные р -орбитали и две sp- гибридных орбитали, находящиеся под углом 1800 (рис. 12, в). а) б) в)
Рис. 12. Положение s- и p-связей в молекулах метана, этилена и ацетилена; s-связи представлены линиями, p-связи – перекрыванием р -орбиталей
|