Свойства атомов
Свойство – это качество, постоянно присущее объекту. Это качество проявляется не само по себе, а в отношении данного объекта с другим. Например, для того, чтобы атом проявлял свойство отдавать электроны, необходим партнер, способный принимать электроны. Такая картина повторяется при описании любых свойств. Поэтому свойство иногда называют «свернутым отношением», подразумевая, что результат отношения объектов приписываем одному из них в качестве свойства, «забывая» о другом объекте. Атомы проявляют свойство обмениваться энергией с окружающей средой. Рассмотрим изменения энергетического состояния атома водорода при взаимодействии с электромагнитным излучением. Стационарное состояние атома соответствует положению электрона на низшем энергетическом уровне Е 1. Переход электрона на более высокий энергетический уровень Е 2 означает поглощение фотона (кванта электромагнитного излучения
Рис. 5. Спектральная серия Бальмера в спектре атома водорода
А томы проявляют свойство отдавать и присоединять электроны. Энергия, которую необходимо затратить, чтобы оторвать электрон от атома, называется энергией ионизации (Еи, кДж/моль), например: Еи Li ® Li+ + е- Сродство атомов к электрону (Есэ, кДж/моль) характеризуется энергией, необходимой для отрыва электрона от соответствующего отрицательного иона (аниона), например: Е сэ Cl- ® Cl + е- Способность атомов участвовать в образовании химических связей включает в себя реакции образования и разрыва между атомами ковалентных, ионных или металлических связей: H + H ® H2 (H-H ковалентная связь) Li + F ® LiF (Li+F- ионная связь) Cu2+ + 2e- ⇄ Cu0 (Cu0 отражает образование металлической связи)
|

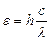 ) и переход атома в возбужденное состояние. В возбужденном состоянии атом пребывает крайне короткое время (~ 10-8 с). В соответствии с законом сохранения энергии возбужденный атом излучает квант поглощенной энергии и возвращается в устойчивое состояние. Квантовые переходы фиксируются приборами в виде линейчатых спектров атома водорода. Один из них представлен на рис. 5.
) и переход атома в возбужденное состояние. В возбужденном состоянии атом пребывает крайне короткое время (~ 10-8 с). В соответствии с законом сохранения энергии возбужденный атом излучает квант поглощенной энергии и возвращается в устойчивое состояние. Квантовые переходы фиксируются приборами в виде линейчатых спектров атома водорода. Один из них представлен на рис. 5.



