Константа электролитической диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации спустя некоторое время скорость диссоциации (прямая реакция) равна скорости моляризации (обратная реакция). Как известно, состояние реакционной системы, при которой скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием. В состоянии химического равновесия концентрации реагирующих веществ в системе остаются постоянными при сохранении постоянных внешних условий. Эти концентрации называются равновесными. При данной температуре отношение произведения равновесных концентраций образующихся веществ к произведению равновесных концентраций веществ, вступающих в реакцию, является величиной постоянной и называется константой химического равновесия (Кх.р). Например, для диссоциации уксусной кислоты СН3СООН ↔ СН3СОО- + Н+ константа химического равновесия имеет вид К х.р. = [Н+] [СН3СОО-] [СН3СООН] Константа химического равновесия для диссоциации слабых электролитов называется константой диссоциации. При изменении концентрации ионов [Н+] или ацетат-ионов [СН3СОО-] соответственно изменится концентрация недиссоциированных молекул [СН3СООН], но значение К дпри данной температуре останется постоянной величиной. Это говорит о том, что в отличие от степени диссоциации α константа диссоциации не зависит от концентрации раствора, но зависит от температуры, природы растворителя и электролита. Это утверждение справедливо только для разбавленных растворов слабых электролитов. Константа диссоциации характеризует способность данной кислоты или основания распадаться на ионы: чем больше значение константы диссоциации, тем сильнее данный электролит. Как известно, многоосновные кислоты и многокислотные основания диссоциируют ступенчато и каждая стадия характеризуется своей константой диссоциации. При ступенчатой диссоциации электролитов распад по следующей ступени всегда происходит в меньшей степени, чем по предыдущей, т.е. К1 > К2 > К3. Это объясняется тем, что энергия, которую надо затратить для отрыва иона, минимальна при его отрыве от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени. Силу электролита можно выразить другим, более удобным способом. Вместо константы диссоциации К дчасто используют ее десятичный логарифм, взятый с обратным знаком: р К д= - lgK д. Например, для уксусной кислоты Кд(СН3СООН) = 1, 76 • 10-5, соответственно рКд(СН3СООН) = 4, 76, где р К дназывается показателем константы диссоциации. Константа диссоциации и степень диссоциации - количественные характеристики диссоциации. Между ними существует соотношение, которое называют законом разведения Оствальда: К д = α 2 / 1- α • С(Х), (1.6)
где С(Х) - концентрация раствора электролита X, моль/л. Для растворов слабых электролитов α < < 1, поэтому величиной α в знаменателе пренебрегают и уравнение (1.6) принимает следующий вид: , илиа = Кд ≈ α 2 С(Х), или α =
Из уравнения (1.7) видно, что с увеличением концентрации а уменьшается, так как величина К дпри данной температуре остается постоянной величиной; при уменьшении концентрации электролита в растворе степень его диссоциации увеличивается.
|

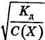 (1.7)
(1.7)


