ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
1. Изменение энтропии в химической реакции равно …. 1) сумме энтропий продуктов реакции 2) разности сумм энтропий исходных веществ и продуктов реакции 3) сумме энтропий исходных веществ 4) разности сумм энтропий конечных и исходных веществ
2. Энтропия идеально построенного кристалла при Т → 0 К стремится к …. 1) – ∞ 2) 0 3) + ∞ 4) – 273
3. Увеличение энтропии системы происходит в ряду превращений …. 1) Н2О (г) → Н2О (ж) → Н2О (т) 2) СО2 (г) → СО2 (т) → СО2 (г) 3) I2 (т) → I2 (ж) → I2 (г) 4) О2 (г) → О2 (ж) → О2 (г)
4. В результате реакций: 4Fе (т) + 3О2 (г) = 2Fе2О3 (т);
Н2 (г) + Сl2 (г) = 2НСl (г)
энтропия систем соответственно …. 1) увеличивается, практически не изменяется 2) уменьшается, увеличивается 3) увеличивается, увеличивается 4) уменьшается, практически не изменяется
5. Для вычисления 1) 2)
3) 4)
6. Энтропия практически не изменяется в реакции …. 1) 2) 3) 4)
7. Энергия Гиббса (изобарно-изотермический потенциал) определяется по уравнению …. 1) G = Н + ТS 2) G = S + ТН 3) G = Н – ТS 4) G = S – ТН
8. Условием возможности химической реакции является …. 1) увеличение энтальпии 2) уменьшение энтропии 3) уменьшение изобарно-изотермического потенциала 4) увеличение энергии Гиббса
9. Химическая реакция возможна при любых температурах, если …. 1) Δ Н < 0 и Δ S < 0 2) Δ Н > 0, а Δ S < 0 3) Δ Н < 0, а Δ S > 0 4) Δ Н > 0 и Δ S > 0
10. Химическая реакция возможна при достаточно высоких температурах, если …. 1) Δ Н < 0 и Δ S < 0 2) Δ Н > 0 и Δ S < 0 3) Δ Н < 0 и Δ S > 0 4) Δ Н > 0 и Δ S > 0
11. Осуществить реакцию N2 (г) + 2О2 (г) = 2NО2 (г) – Q …. 1) невозможно ни при каких температурах 2) можно при любых температурах 3) можно при низких температурах 4) можно при высоких температурах
12. При стандартных условиях термодинамически возможна реакция …. 1) 2N2 (г) + О2 (г) = 2N2О (г), Δ Н0 > 0 2) 4NН3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (г), Δ Н0 < 0 3) 2Сl2 (г) + 2Н2О (г) = 4НСl (г) + О2 (г), Δ Н0 > 0 4) 2NО (г) + О2 (г) = 2NО2 (т), Δ Н0 < 0
13. При стандартных условиях термодинамически более устойчивым соединением является …. 1) Н2О (Δ G 2) Н2S (Δ G 3) Н2Sе (Δ G 4) Н2Те (Δ G
14. Изменение энергии Гиббса (свободной энергии) в химической реакции равно …. 1) сумме энергий Гиббса продуктов реакции 2) сумме энергий Гиббса исходных веществ 3) разности сумм энергий Гиббса исходных веществ и продуктов реакции 4) разности сумм энергий Гиббса продуктов и исходных веществ
15. Температура, при которой равновероятны оба направления реакции
N2 (г) + 3Н2 (г)
равна … К.
1) 92, 182 2) 466, 6 3) 2, 1·10–3 4) 18, 3
16. Из водородных соединений элементов VIА группы
Н2О (г), Н2S (г), Н2Sе (г), Н2Те (г) (Δ G0298, кДж/моль: –229 –34 + 71 + 138)
термодинамически из простых веществ можно получить …. 1) Н2Sе и Н2S 2) Н2О и Н2S 3) Н2Те и Н2S 4) Н2Sе и Н2О
17. При стандартных условиях из простых веществ термодинамически можно получить …. 1) Сl2О (г) и СuО (т) (Δ G
2) СаСl2 (т) и НСl (г) (Δ G
3) С2Н4 (г) и С2Н6 (г) (Δ G
4) NО (г) и NН3 (г) (Δ G
18. Из значений изменений энергий Гиббса (Δ G
СаО (т) + SО3 (г) = СаSО4 (т) (Δ G ВаО (т) + SО3 (г) = ВаSО4 (т) (Δ G СuО (т) + SО3 (г) = СuSО4 (т) (Δ G FеО (т) + SО3 (г) = FеSО4 (т) (Δ G
следует, что наиболее выраженными оснó вными свойствами обладает …. 1) СuО 2) СаО 3) ВаО 4) FеО
19. Знаки изменения свободной энергии реакций:
РbО2 (т) + Рb (т) = 2РbО (т) (Δ G SnО2 (т) + Sn (т) = 2SnО (т) (Δ G
показывают, что для атомов свинца и олова более характерными в химических соединениях являются степени окисления соответственно …. 1) +4 и +2 2) +2 и +4 3) +4 и +4 4) +2 и +2
|

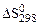 реакции NН4NО2 (т) = N2 (г) + 2Н2О (ж) следует воспользоваться уравнением ….
реакции NН4NО2 (т) = N2 (г) + 2Н2О (ж) следует воспользоваться уравнением ….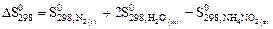

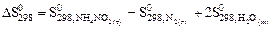

 =
= 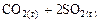
 =
= 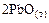
 =
= 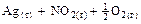
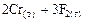 =
= 
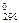 = –229 кДж/моль)
= –229 кДж/моль) 2NН3 (г) (Δ Н0 = –92, 38 кДж, Δ S0 = –0, 198 кДж/К),
2NН3 (г) (Δ Н0 = –92, 38 кДж, Δ S0 = –0, 198 кДж/К),


