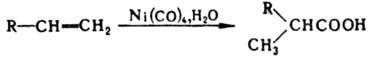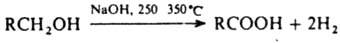Тема: Альдегиды. Карбоновые кислоты. Углеводы
АЛЬДЕГИДЫ [сокр. от новолат. al(cohol)dehyd(rogenatum) -алкоголь, лишенный водорода], орг. соед., содержащие альдегидную группу СНО. По номенклатуре ИЮПАК назв. альдегидов производят прибавлением к назв. соответствующего углеводорода суффикса " аль" или к назв. углеводорода, содержащего на один атом С меньше, суффикса " карбальдегид"; в первом случае углерод альдегидной группы нумеруется цифрой 1, во втором-альдегидная группа в нумерацию цепи не включается. В полифункциональных соед. альдегидная группа обозначается приставкой " формил", напр. соед. ОСНСН2СН (СНО)СН2СНО наз. 1, 2, 3-пропантрикарбальдегид или 3-формилпентандиаль; нек-рые альдегиды имеют тривиальные названия (см. табл.). СВОЙСТВА АЛЬДЕГИДОВ
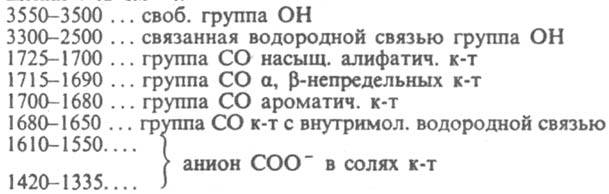
В ИК-спектрах альдегидов характеристич. полосы поглощения vС=о лежат в области 1740-1720 см-1 (алифатич. альдегиды), 1715-1695 см-1 (ароматич.), 1705-1685 см-1 Альдегиды - один из наиб. реакционноспособных классов орг. соединений. Низшие альдегиды легко полимеризуются. По степени окисленности альдегиды занимают промежут. положение между спиртами и карбоновыми к-тами, чем во многом определяются их св-ва. Альдегиды легко окисляются О2 воздуха до к-т уже при хранении (промежут. продукт - пероксикислота):
Восстанавливаются под действием Н2 (кат.-Pt или Ni), а также донорами гидрид-ионов, напр. LiAlH4 и NaBH4, в первичные спирты. При восстановлении ароматич. альдегидов металлами или электрохимически получаются лиарилзамещенные Вследствие поляризации связи Исключительно важна в орг. синтезе альдольная конденсация с образованием гидроксиальдегидов. Последние легко отщепляют воду, превращаясь в В сходных р-циях ароматич. альдегидов с ангидридами карбоновых к-т (р-ция Перкина), а также алифатич. и ароматич. альдегидов с эфирами малоновой к-ты (р-ция Кнёвенагеля) образуются соответственно Конденсация альдегидов с эфирами янтарной к-ты приводит к алкилиденянтарным к-там (р-ция Штоббе), с аминокислотами - к азлактонам (р-ция Эрленмейера - Плёхля). Нуклеоф. присоединение по карбонильной группе альдегидов лежит в основе синтеза: спиртов - взаимод. альдегидов с реактивами Гриньяра или другими металлоорг. соед., а также с ацетиленом (р-ция Реппе): 2СН2О + НС Карбонильная группа альдегидов способна участвовать также в р-циях Анри, Кижнера - Вольфа, Лейкарта, Штреккера и др. Альдегиды (гл. обр. СН2О) реагируют как электроф. реагенты с олефинами, образуя 1, 3-диоксаны и 1, 3-гликоли (р-ция Принса), напр.: Электроф. замещение в ароматич. ядре под действием альдегидов приводит к арилкарбинолам. Р-ция СН2О с фенолами лежит в основе произ-ва феноло-формальд. смол. Альдегиды, содержащие ос-атом Н, легко образуют енолы и еноляты, к-рые реагируют как нуклеофилы при галогенировании их Вr2, N-бромсукцинимидом, SO2C12, при тиилировании дисульфидами, алкилировании и ацилировании алкили ацилгалогенидами. При гомолитич. присоединении альдегидов к олефинам, инициируемом пероксидами или О2, образуются кетоны, при фотохим. р-ции альдегидов с олефинами - оксациклобутаны (оксетаны), напр.: Альдегиды декарбонилируются (кат.-Rh) с образованием углеводородов. К альдегидам относятся важнейшие моно- и олигосахариды - глюкоза, лактоза и др. Содержатся альдегиды в эфирных маслах, напр. цитраль - в лемонграссовом (до 80%) и кориандровом маслах, цитронеллаль - в цитронелловом (~ 30%) и эвкалиптовом, бензальдегид - в масле горького миндаля; плоды ванили содержат 1, 5-3% ванилина. Дегидрирование спиртов над Ag, Си или монохромовыми катализаторами - наиб. общий пром. метод произ-ва альдегидов (в осн. формальдегида и альдегидов состава С5 и выше). Ацетальдегид производят гл. обр. окислением этилена, а также каталитич. гидратацией ацетилена (р-ция Кучерова), акролеинокислением пропилена, пропионовый и масляный альдегиды - гидроформилированием соотв. этилена и пропилена. Альдегиды синтезируют в пром-сти также каталитич. восстановлением карбоновых к-т (гл. обр. высших) муравьиной к-той, гидролизом дигалогенозамещенных углеводородов. Препаративные методы получения альдегидов: окисление спиртов хроматами или кетонами в присут. алкоголятов А1 (р-ция Оппенауэра); озонолиз олефинов; восстановление разл. производных карбоновых к-т, напр. хлорангидридов-Н2 в присут. Pd (р-ция Розенмунда), нитрилов-гидридами металлов с послед. гидролизом образующихся альдиминов и т.п.; взаимод. реактивов Гриньяра с ортомуравьиным эфиром; перегруппировка аллилвиниловых эфиров (перегруппировка Клайзена); окисление 1, 2-гликолей йодной к-той или (СН3СОО)4Рb, а также р-ции Даффа, Нефа, Раймера-Тимана, Соммле, синтезы Гаттермана и Гаттермана- Коха. Для качеств. определения альдегидов обычно применяют р-р AgNO3 в избытке водного р-ра NH3 (образование серебряного зеркала) или реактив Фелинга-щелочной р-р, содержащий CuSO4 и соль винной к-ты (выделение красного осадка Си2О). Эти реагенты не взаимодействуют с кетонами. Альдегиды применяют для получения спиртов (бутиловых, 2-этилгексанола, пентаэритрита и др.), карбоновых к-т и их производных (напр., уксусной, надуксусной, уксусного ангидрида, винилацетата, Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные. КАРБОНОВЫЕ КИСЛОТЫ, орг. соед., содержащие карбоксильную группу СООН. По кол-ву этих групп различают одно-, двух- и многоосновные к-ты (см. также Дикарбоновые кислоты). Могут содержать Hal, а также группы NH2, С=О, ОН (соотв. галогенкарбоновые кислоты, аминокислоты, альдегидо- и кетокислоты, оксикислоты). Алифатич. к-ты, у к-рых число атомов С в молекуле больше 6, относят к высшим жирным кислотам. По номенклатуре ИЮПАК, к-ты называют, выбирая за основу наиб. длинную цепь, содержащую группу СООН, и добавляя к назв. соединения-основы окончание " овая" и слово " к-та"; атому С карбоксильной группы приписывают номер 1, напр. СН3(СН2)4СН(СН3)СООН - 2-метилгептановая к-та. Часто к назв. соединения-основы добавляют слова " карбоновая к-та", напр. С6Н11СООН - циклогексанкарбоновая к-та. При использовании этого способа наименования в алифатич. ряду атом С карбоксильной группы в нумерацию цепи не включается. Мн. к-ты имеют тривиальные названия (см. табл.). В своб. состоянии к-ты находятся в плодах нек-рых растений, крови, выделениях животных; они входят в состав жиров, эфирных и растит. масел, восков. Важную роль карбоновые кислоты играют в обмене веществ.
УГЛЕВОДЫ (сахара), обширная группа полигидроксикарбо-нильных соед., входящих в состав всех живых организмов; к углеводам относят также мн. производные, получаемые при хим. Mодификации этих соед. путем окисления, восстановления или введения разл. заместителей. Термин " углеводы" возник потому, что первые известные представители углеводов по составу отвечали ф-ле CmH2nOn (угле-род+вода); впоследствии были обнаружены природные углеводы с др. элементным составом. Классификация и распространение. Углеводы принято делить на моносахариды, олигосахариды и полисахариды. Моносахариды обычно представляют собой полигид-роксиальдегиды (альдозы) или полигидроксикетоны (кетозы) с линейной цепью из 3-9 атомов С, каждый из к-рых (кроме карбонильного) связан с группой ОН. Простейший моноса-харид, глицериновый альдегид, содержит один асим. атом С и известен в виде двух оптич. антиподов (D и L). Прочие моносахариды имеют неск. асим. атомов С; их рассматривают как производные D- или L-глицеринового альдегида и относят к D- или L-ряду в соответствии с абс. конфигурацией асим. атома С, наиб. удаленного от карбонильной группы. Различия между изомерными моносахаридами в каждом ряду обусловлены относит, конфигурацией остальных асим. центров. Характерное св-во моносахаридов в р-рах - мутаротация, т. е. установление таугомерного равновесия между ациклич. альдегидо- или кетоформой, двумя пятичленными (фураноз-ными) и двумя шестичленными (пиранозными) полуацеталь-ными формами. Две пиранозы (как и две фуранозы) отличаются друг от друга конфигурацией (a или b) нового асим. (аномерного) центра, возникающего из карбонильного атома С при циклизации. Полуацетальный (гликозидный) гидроксил циклич. форм моносахаридов резко отличается от прочих групп ОН моно-сахарида значительно большей склонностью к р-циям нукле-оф. замещения. Такие р-ции приводят к образованию глико-зидов (остаток нуклеофила в гликозиде - напр. спирта. меркаптана - носит назв. агликон). В тех случаях, когда агликоном служит др. молекула моносахарида, образуются олиго- и полисахариды. При этом каждый остаток моносахарида может в принципе иметь пиранозную или фуранозную форму, a- или b-конфигурацию гликозидного центра и быть связанным с любой из гидроксильных групп соседнего моносахарида. Поэтому число разл. по строению полимерных молекул, к-рые теоретически можно построить даже из остатков только одного моносахарида, представляет собой аст-рономич. величину. К наиб, обычным и распространенным в природе моноса-харидам относят D-глюкозу, D-галактозу, D-маннозу, D-фрук-тозу, D-ксилозу, L-арабинозу и D-рибозу. Из представителей др. классов моносахаридов часто встречаются: 1) дезоксиса-хара, в молекулах к-рых одна или неск. групп ОН заменены атомами H (напр., L-рамноза, L-фукоза, 2-дезокси-D-рибоза); 2) аминосахара, где одна или неск. групп ОН заменены на аминогруппы (напр., 2-амино-2-дезокси-D-глюкоза, или D-глюкозамин); 3) многоатомные спирты (полиолы, альди-ты), образующиеся при восстановлении карбонильной группы моносахаридов (D-сорбит из D-глюкозы, D-маннит из D-маннозы, и др.); 4) уроно-вые кислоты - альдозы, у к-рых группа CH2OH окислена в карбоксильную (напр., D-глюкуроновая к-та); 5) разветвленные сахара, содержащие нелинейную цепь углеродных атомов (напр., апиоза, или 3-С- гидроксиметил-D-глицеро-тетроза; ф-ла I); 6) высшие сахара с длиной цепи более шести атомов С (напр., D-седогеп-тулоза и сиаловые к-ты; ф-лы см. соотв. в статьях Пентозо-фосфатный цикл и Моносахариды}.
За исключением D-глюкозы и D-фруктозы своб. моносахариды встречаются в природе редко. Обычно они входят в состав разнообразных гликозидов, олиго- и полисахаридов и м. б. получены из них после кислотного гидролиза. Разработаны многочисл. методы хим. синтеза редких моносахаридов исходя из более доступных. Олигосахариды содержат в своем составе от 2 до 10-20 моносахаридных остатков, связанных гликозидными связями. Наиб, распространены дисахариды, выполняющие ф-цию запасных B-B: сахароза в растениях, трегалоза в насекомых и грибах, лактоза в молоке млекопитающих. Известны многочисл. гликозиды олигосахаридов, к к-рым относят разл. физиологически активные в-ва, напр, гликозиды сердечные, нек-рые сапонины (в растениях), мн. антибиотики (в грибах и бактериях), гликолипиды. Полисахариды- высокомол. соед., линейные или разветвленные молекулы к-рых построены из остатков моносахаридов, связанных гликозидными связями. В состав полисахаридов могут входить также заместители неуглеводной природы (остатки алифатич. к-т, фосфат, сульфат). В свою очередь цепи высших олигосахаридов и полисахаридов могут присоединяться к полипептидным цепям с образованием гликопротеинов. Особую группу составляют биополимеры, в молекулах к-рых остатки полиолов, гликозилполиолов, нуклеозидов или моно- и олигосахаридов соединены не гликозидными, а фос-фодиэфирными связями. К этой группе относят тейхоевые кислоты бактерий, компоненты клеточных стенок нек-рых дрожжей, а также нуклеиновые кислоты, в основе к-рых лежит поли-D-рибозофосфатная (РНК) или поли-2-дезок-си-D-рибозофосфатная (ДНК) цепь. Физико-химические свойства. Обилие полярных функц. групп в молекулах моносахаридов приводит к тому, что эти в-ва легко раств. в воде и не раств. в малополярных орг. р-рителях. Способность к таутомерным превращениям обычно затрудняет кристаллизацию моно- и олигосахаридов, однако если такие превращения невозможны (напр., как в гликозидах и невосстанавливающих олигосахаридах типа сахарозы), то в-ва кристаллизуются легко. Mн. гликозиды с малополярными агликонами (напр., сапонины) проявляют св-ва ПАВ. Полисахариды - гидрофильные полимеры, мн. из них образуют высоковязкие водные р-ры (растит, слизи, гиалуроно-вая к-та; ф-лу последней см. в ст. Мукополисахариды), а в ряде случаев (в результате своеобразной межмол. ассоциации) - прочные гели (агар, алъгиновые кислоты, каррагинаны, пектины). Нек-рые полисахариды образуют высокоупорядоченные надмолекулярные структуры, препятствующие гидратации отдельных молекул; такие полисахариды (напр., хитин, целлюлоза)не раств. в воде. Биологическая роль. Ф-ции углеводов в живых организмах чрезвычайно многообразны. В растениях моносахариды являются первичными продуктами фотосинтеза и служат исходными соед. для биосинтеза гликозидов и полисахаридов, а также др. классов B-B (аминокислот, жирных K-T, фенолов и др.). Эти превращения осуществляются ферментами, субстратами для к-рых служат, как правило, богатые энергией фос-форилир. производные Сахаров, гл. обр. нуклеозиддифосфат-сахара. Углеводы запасаются в растениях (в виде крахмала), животных, бактериях и грибах (в виде гликогена), где служат энергетич. резервом. Источником энергии являются р-ции расщепления глюкозы, образующейся из этих полисахаридов, по гликоли-тич. или окислит. пути (см. Гликолиз). В виде гликозидов в растениях и животных осуществляется транспорт разл. метаболитов. Полисахариды и более сложные углеводсодержащие полимеры выполняют в живых организмах опорные ф-ции. Жесткая клеточная стенка у высших растений представляет собой сложный комплекс из целлюлозы, гемицеллюлоз и пектинов. Армирующим полимером в клеточной стенке бактерий служат пептидогликаны (муреины), а в клеточной стенке грибов и наружных покровах членистоногих - хитин. В организме животных опорные ф-ции выполняют протео-гликаны соединит, ткани, углеводная часть молекул к-рых представлена сульфатир. мукополисахаридами. Эти в-ва участвуют в обеспечении специфич. физ.-хим. CB-B таких тканей, как кости, хрящи, сухожилия, кожа. Будучи гидрофильными полианионами, эти полисахариды способствуют также поддержанию водного баланса и избират. ионной проницаемости клеток. Аналогичные ф-ции в морских многоклеточных водорослях выполняют сульфатир. галактаны (красные водоросли) или более сложные сульфатир. гетерополисахари-ды (бурые и зеленые водоросли); в растущих и сочных тканях высших растений эту ф-цию выполняют пектины. Особенно ответственна роль сложных углеводов в образовании клеточных пов-стей и мембран и придании им специфич. св-в. Так, гликолипиды - важнейшие компоненты мембран нервных клеток и оболочек эритроцитов, а липополисахариды -наружной оболочки грамотрицат. бактерий. Углеводы клеточной пов-сти часто определяют специфичность иммунологич. р-ций (групповые в-ва крови, бактериальные антигены) и взаимод. клеток с вирусами. Углеводные структуры принимают участие и в др. высокоспецифич. явлениях клеточного взаимод., таких, как оплодотворение, узнавание клеток при тканевой дифференциации, отторжение чужеродных тканей и т. д. Практическое использование. Углеводы составляют главную часть пищ. рациона человека, в связи с чем широко используются в пищ. и кондитерской пром-сти (крахмал, сахароза и др.). Кроме того, в пищ. технологии применяют структурир. в-ва полисахаридной природы, не имеющие сами по себе пищ. ценности, - гелеобразователи, загустители, стабилизаторы суспензий и эмульсий (альгинаты, агар, пектины, растит. галактоманнаны и др.). Превращения моносахаридов при спиртовом брожении лежат в основе процессов получения этанола, пивоварения, хлебопечения; др. виды брожения позволяют получать из Сахаров биотехнол. методами глицерин, молочную, лимонную, глюконовую к-ты и мн. др. в-ва. Глюкозу, аскорбиновую к-ту, углеводсодержащие антибиотики, гепарин широко применяют в медицине. Целлюлоза служит основой для получения вискозного волокна, бумаги, нек-рых пластмасс, BB и др. Сахарозу и растит, полисахари-ды рассматривают как перспективное возобновляемое сырье, способное в будущем заменить нефть в пром. орг. синтезе. Моносахариды используют в качестве доступных хиральных исходных соед. для синтеза сложных прир. B-B неуглеводной природы.
|

 непредельные); VC_H -B области 2880-2650 см-1. Хим. сдвиг альдегидного протона в спектрах ЯМР (1Н)-в области 9, 4-9, 7 м.д. (алифатич. альдегиды) и 9, 6-10, 1 м.д. (ароматич.). Характерный дублет в спектрах ЯМР (13С), обусловленный группой 13СНО - в области 190-205 м.д. (на 5-10 м.д. в более сильном поле, чем сдвиги 13СО соответствующих кетонов). Электронные спектры содержат полосы с
непредельные); VC_H -B области 2880-2650 см-1. Хим. сдвиг альдегидного протона в спектрах ЯМР (1Н)-в области 9, 4-9, 7 м.д. (алифатич. альдегиды) и 9, 6-10, 1 м.д. (ароматич.). Характерный дублет в спектрах ЯМР (13С), обусловленный группой 13СНО - в области 190-205 м.д. (на 5-10 м.д. в более сильном поле, чем сдвиги 13СО соответствующих кетонов). Электронные спектры содержат полосы с  290 нм для RCHO (R = CH3, C2H5, С3Н7), 345 нм для акролеина и 327 нм для кретонового альдегида (во всех случаях
290 нм для RCHO (R = CH3, C2H5, С3Н7), 345 нм для акролеина и 327 нм для кретонового альдегида (во всех случаях  15-25); масс-спектры (RCHO)-пики, отвечающие ионам (НСО) +, (RCO) + и R +. Если альдегидв имеют атомы Н в
15-25); масс-спектры (RCHO)-пики, отвечающие ионам (НСО) +, (RCO) + и R +. Если альдегидв имеют атомы Н в  положении, то для линейных соед. характерны пики при т/е 44, а для
положении, то для линейных соед. характерны пики при т/е 44, а для  разветвленных - при т/е 44 + 12и, где п — 1, 2, 3...
разветвленных - при т/е 44 + 12и, где п — 1, 2, 3...
 гликоли. Диспропорционируют с образованием спирта и к-ты: 2С6Н5СНО + Н2О -> С6Н5СН2ОН + С6Н5СООН (р-ция Канниццаро) или сложного эфира: 2RCHO -> RCOOCH2R (р-ция Тищенко). Восстанавливаются спиртами в присут. алкоголята А1 (р-ция Меервейна-Понндорфа-Верлея): RCHO + (СН3)2СНОН
гликоли. Диспропорционируют с образованием спирта и к-ты: 2С6Н5СНО + Н2О -> С6Н5СН2ОН + С6Н5СООН (р-ция Канниццаро) или сложного эфира: 2RCHO -> RCOOCH2R (р-ция Тищенко). Восстанавливаются спиртами в присут. алкоголята А1 (р-ция Меервейна-Понндорфа-Верлея): RCHO + (СН3)2СНОН  RCH2OH + (СH3)2 = О. Ароматич. альдегиды вступают в бензоиновую конденсацию.
RCH2OH + (СH3)2 = О. Ароматич. альдегиды вступают в бензоиновую конденсацию. альдегиды способны присоединять по карбонильной группе нуклеофилы: воду, спирты, амины и др. Обычно альдегиды значит. активнее в р-циях с нуклеофилами, чем кетоны. наиб. легко реагирует формальдегид, к-рый в водном р-ре находится преим. в гидра-тированной форме. В спиртовом р-ре альдегиды образуют последовательно полуацетали и ацетали: RCHO + R'OH -> RCH(OR')OH
альдегиды способны присоединять по карбонильной группе нуклеофилы: воду, спирты, амины и др. Обычно альдегиды значит. активнее в р-циях с нуклеофилами, чем кетоны. наиб. легко реагирует формальдегид, к-рый в водном р-ре находится преим. в гидра-тированной форме. В спиртовом р-ре альдегиды образуют последовательно полуацетали и ацетали: RCHO + R'OH -> RCH(OR')OH  RCH(OR')2, при взаимод. с гидро-ксиламином-оксимы RCH=NOH, с гидразином-гидра-зоны RCH=NNH2 и азины, с первичными аминами-основания Шиффа (азометины) RCH=NR'; со вторичными аминами A. RCH2CHO дают енамины RCH=CHNR2. Из СН2О и NH3 в пром-сти получают гексаметилентетрамин (уротропин). Образование ацеталей и енаминов используется в синтезе как метод защиты альдегидной группы; р-ция альдегидов с NaHSO3, приводящая к кристаллич. аддуктам, - для выделения и очистки альдегидов.
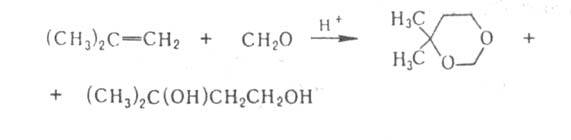
RCH(OR')2, при взаимод. с гидро-ксиламином-оксимы RCH=NOH, с гидразином-гидра-зоны RCH=NNH2 и азины, с первичными аминами-основания Шиффа (азометины) RCH=NR'; со вторичными аминами A. RCH2CHO дают енамины RCH=CHNR2. Из СН2О и NH3 в пром-сти получают гексаметилентетрамин (уротропин). Образование ацеталей и енаминов используется в синтезе как метод защиты альдегидной группы; р-ция альдегидов с NaHSO3, приводящая к кристаллич. аддуктам, - для выделения и очистки альдегидов. непредельные альдегиды (кретоновая конденсация):
непредельные альдегиды (кретоновая конденсация): 
 непредельные кислоты или их эфиры, например:
непредельные кислоты или их эфиры, например: 
 СН -> НОСН2С
СН -> НОСН2С  ССН2ОН;
ССН2ОН;  аминокарбонильных соед.-взаимод. альдегидов или кетонов с СН2О и аминами (р-ция Манниха): СН3СОСН3 + СН2О + (С2Н5)2МН * НС1 -> СН3СОСН2СН2М(С2Н5)2 * НС1 + Н2О; олефинов - конденсацией альдегидов с алкилиденфосфоранами (р-ция Виттига): RCH2O + (С6Н5)3
аминокарбонильных соед.-взаимод. альдегидов или кетонов с СН2О и аминами (р-ция Манниха): СН3СОСН3 + СН2О + (С2Н5)2МН * НС1 -> СН3СОСН2СН2М(С2Н5)2 * НС1 + Н2О; олефинов - конденсацией альдегидов с алкилиденфосфоранами (р-ция Виттига): RCH2O + (С6Н5)3  -СН2 -> RCH=CH2 + (С6Н5)3РО; глицидных эфиров - р-цией альдегидов с эфирами
-СН2 -> RCH=CH2 + (С6Н5)3РО; глицидных эфиров - р-цией альдегидов с эфирами  галогенкарбоновых к-т (р-ция Дарзана):
галогенкарбоновых к-т (р-ция Дарзана): 

 ацетопропилацетата), полимеров, антиоксидантов, пиридиновых оснований и др. Альдегиды, содержащие 8-12 атомов С, -душистые в-ва. наиб. объем мирового произ-ва альдегидов (неск. млн. т/год) приходится на альдегиды С1-С4.
ацетопропилацетата), полимеров, антиоксидантов, пиридиновых оснований и др. Альдегиды, содержащие 8-12 атомов С, -душистые в-ва. наиб. объем мирового произ-ва альдегидов (неск. млн. т/год) приходится на альдегиды С1-С4.