Тема: Кислородсодержащиеорганические соединения. Спирты фенолы
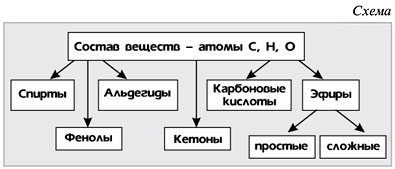
Классификация кислородсодержащих
П р и м е р ы: муравьиная кислота, щавелевая кислота, лимонная, яблочная, молочная кислоты, «винный спирт» (этанол), формалин (40%-й раствор муравьиного альдегида в воде), глицерин, ацетон, эфир для наркоза (диэтиловый эфир), фенол. Классификацию спиртов, альдегидов и кислот можно проводить по числу функциональных групп в молекулах. Различают одно-, двух- и трехатомные спирты:
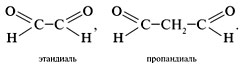
Альдегиды с двумя альдегидными группами СНО в молекуле называют следующим образом:
Карбоновые кислоты в зависимости от числа карбоксильных групп в молекуле бывают одно-, двух- и трехосновные:
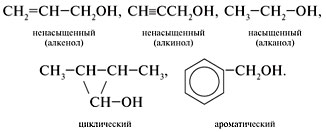
Кислородсодержащие соединения различаются по строению углеводородного радикала. Они бывают предельные (насыщенные), непредельные (ненасыщенные), циклические, ароматические. Примеры спиртов:
Примеры альдегидов:
Примеры карбоновых кислот:
Номенклатура По международной номенклатуре ИЮПАК названия спиртов производят из названий соответствующих алканов с добавлением суффикса «ол».
Спирты - органические соединения, в состав молекул которых входит одна или несколько гидроксильных групп, соединенных с углеводородным радикалом. По числу гидроксильных групп в молекуле спирты делятся на одноатомные, двухатомные трехатомные и т. д.
Одноатомные спирты Общая формула одноатомных спиртов - R—OH. По типу углеводородного радикала спирты делятся на предельные, непредельные и ароматические.
Общая формула предельных одноатомных спиртов - C n N2 n +1—OH. Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца называются фенолами. Например, C6H5—OH - гидроксобензол (фенол). По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R') и третичные (RR'R''C—OH) спирты.
C n N 2n+2 O - общая формула и предельных одноатомных спиртов, и простых эфиров. Предельные одноатомные спирты изомерны простым эфирам - соединениям с общей формулой R—O—R'.
Изомеры и гомологи
Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия. Алгоритм составления названий одноатомных спиртов Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа. Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа. Назовите соединение по алгоритму для углеводородов. В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа. Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей:
С этим же связана и хорошая растворимость в воде низших спиртов. Простейшие спирты - жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных - больше, чем у третичных. Метанол крайне ядовит. Химические свойства спиртов Горение: C2H5OH + 3O2 Реакции с щелочными и щелочноземельными металлами (" кислотные" свойства): 2Na + 2H—O—H Атомы натрия легче восстанавливают те атомы водорода, у которых больше положительный частичный заряд ( Молекулу спирта можно рассматривать как молекулу воды, в которой один из атомов водорода замещен углеводородным радикалом. А такой радикал, богатый электронными парами, легче, чем атом водорода, позволяет атому кислорода оттягивать на себя электронную пару связи R Атом кислорода как бы " насыщается", и за счет этого связь O—H оказывается менее поляризованной, чем в молекуле воды ( В результате атомы натрия труднее восстанавливают атомы водорода в молекулах спиртов, чем в молекулах воды, и реакция идет намного медленнее. Иногда, основываясь на этом, говорят, что кислотные свойства спиртов выражены слабее, чем кислотные свойства воды. Из-за влияния радикала кислотные свойства спиртов убывают в ряду метанол
Реакции с галогеноводородами: C2H5OH + HBr
Внутримолекулярная дегидратация (t > 140oС, образуются алкены): C2H5OH
Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры): 2C2H5OH
Окисление (мягкое, до альдегидов): CH3CH2OH + CuO
Получение спиртов Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH Гидратация алкенов: C2H4 + H2O Брожение глюкозы: C6H12O6 Синтез метанола: CO + 2H2 Многоатомные спирты Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль) HO—CH2—CH2—OH и трехатомный спирт пропантриол-1, 2, 3 (глицерин) HO—CH2—CH(OH)—CH2—OH. Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль ядовит. Химические свойства многоатомных спиртов по большей части сходны с химическими свойствами одноатомных спиртов, но кислотные свойства из-за влияния гидроксильных групп друг на друга выражены сильнее. Качественной реакцией на многоатомные спирты является их реакция с гидроксидом меди(II) в щелочной среде, при этом образуется ярко-синие растворы сложных по строению веществ. Например, для глицерина состав этого соединения выражается формулой Na2[Cu(C3H6O3)2]. Фенолы Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол) C6H5—OH. Физические свойства фенола: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой. Химические свойства Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
C6H5OH + NaOH
Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной а) Реакция с бромной водой (качественная реакция):
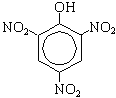
б) Нитрование (при комнатной температуре): C6H5—OH + HNO3(разб.)
Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
|

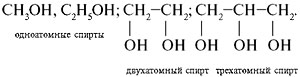



 пропантриол-1, 2, 3 (глицерин)
пропантриол-1, 2, 3 (глицерин)
 бутанол-2 (втор -бутиловый спирт)
бутанол-2 (втор -бутиловый спирт)
 2-метилпропанол-2 (трет -бутиловый спирт)
2-метилпропанол-2 (трет -бутиловый спирт)
 пропанол-2
пропанол-2
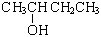 бутанол-2
бутанол-2
 2-метил-пропанол-2
2-метил-пропанол-2
 2-метил-пропанол-1
2-метил-пропанол-1

 2CO2 +3H2O + Q
2CO2 +3H2O + Q
 +). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей.
+). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей. C2H5Br + H2O
C2H5Br + H2O C2H4 + H2O
C2H4 + H2O CH3—CHO + Cu + H2O
CH3—CHO + Cu + H2O C2H5OH.
C2H5OH. -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто - и пара -положения) и уменьшается у 3-го и 5-го атомов углерода (мета -положение).
-системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто - и пара -положения) и уменьшается у 3-го и 5-го атомов углерода (мета -положение).