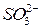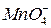Кислоты
Кислотами называются соединения, содержащие атомы водорода, связанные с кислотными остатками. О названиях бескислородных кислот см. разд. «Галогениды» и «Соединения элементов с другими неметаллами». Для кислотных оксидов, гидратированных неопределенным числом молекул воды, например SO 2 × nH 2 O, недопустимо писать формулы типа H 2 SO 3; называть подобные соединения кислотами также не рекомендуется. Пример: SO 2 × nH 2 O – полигидрат диоксида серы. Оксокислоты (кислородсодержащие кислоты). Оксокислоты – это соединения с общей формулой H x A y O z, где A y O z – кислотный остаток и А – кислотообразующий элемент. Традиционное название оксокислоты складывается из двух слов: собственно названия данной кислоты, выраженного прилагательным, и группового слова «кислота», например: серная кислота, азотная кислота. В собственно названиях оксокислот для обозначения степени окисления элемента А применяют суффиксы, которые добавляют к корню русского названия кислотообразователя (табл. 2). Окончание в названии кислоты всегда -ая. Таблица 2 Правила образования названий оксокислот
По традиции кислоту H 2 CO 3 называют угольной кислотой. Иногда элемент А в одной и той же степени окисления образует две кислоты, различающиеся по «содержанию воды». Для кислоты, содержащей меньшее число атомов водорода и кислорода, перед названием ставят приставку мета-, а при большем содержании – приставку орто-, например: HAsO 3 – метамышьяковая кислота; H 3 AsO 4 – ортомышьяковая кислота. Оксокислоты, содержащие два или более атомов элемента А, носят название изополикислоты. Примеры традиционных названий изополикислот:
Соли Названия солей тесно связаны с номенклатурой неорганических кислот. Соли многих распространенных кислот имеют традиционные названия, укоренившиеся в русском химическом языке, такие как нитраты, сульфаты и др. Эти традиционные названия сохраняются в современной номенклатуре. Для относительно сложных и малоизвестных веществ рекомендуется использовать систематические названия. Средние соли оксокислот. Традиционные названия солей состоят из названий анионов в именительном падеже и названий катионов в родительном падеже. Названия анионов средних солей распространенных оксокислот строят из корней русских или латинских названий кислотообразующих элементов А с соответствующими суффиксами (табл. 3). Таблица 3 Названия ионов оксокислот и их солей
Примеры традиционных названий некоторых распространенных оксокислот и их средних солей сведены в табл. 4.
Таблица 4 Названия кислот и солей
Кислые соли (гидросоли). Традиционные названия кислых солей образуют добавляя к названию аниона соответствующей средней соли приставку гидро-. Примеры традиционных названий кислых солей:
Основные соли (гидроксосоли). Традиционные названия основных солей образуют добавляя к наименованию аниона соответствующей средней соли приставку гидроксо-. Примеры традиционных названий основных солей: (ZnOH)NO 3– гидроксонитрат цинка; (CuOH) 2 CO 3– гидроксокарбонат меди (II). Кристаллогидраты солей. Названия кристаллогидратов солей состоят из группового слова «гидрат» (с приставкой, отвечающей числу молекул воды) и традиционного (если оно имеется) или систематического названия соли. Пример названия кристаллогидратов солей: CuSO 4× 5 H 2 O – пентагидрат сульфата меди (II).
|