Лабораторная работа № 1. Цель работы: знакомство с различными классами неорганических соединений, получение некоторых из них и исследование их свойств
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Цель работы: знакомство с различными классами неорганических соединений, получение некоторых из них и исследование их свойств. Все вещества делятся на простые и сложные. Простые вещества состоят из атомов одного элемента (H 2, O 2, Zn, S), а сложные – из двух или более (H 2 O, H 2 SO 4, ZnCl 2). Простые вещества можно разделить на металлы и неметаллы, а сложные – на органические (соединения углерода) и неорганические. Неорганические вещества делятся на классы: оксиды, основания, кислоты и соли. Оксиды Оксидами называются соединения элементов с кислородом. По химическим свойствам оксиды делятся на: – кислотные оксиды, которые при взаимодействии с основаниями и основными оксидами образуют соли и, присоединяя воду (непосредственно или косвенно), образуют кислоты; общая формула: Э х О у, – основные оксиды, которые при взаимодействии с кислотами и кислотными оксидами образуют соли и, присоединяя (непосредственно или косвенно) воду, образуют основания; их общая формула: Ме 2 О, МеO. Например: Na 2 O, CaO. Исключение составляют оксиды BeO, ZnO, PbO, SnO, которые являются амфотерными; – амфотерные оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями; их общая формула: Э 2 О 3, ЭО 2. Например: Al 2 O 3, Fe 2 O 3, TiO 2. Основные гидроксиды (основания) Основаниями называются сложные вещества, диссоциирующие в водном растворе с образованием гидроксильных групп (ОН–). Например: Общая формула: Me(OH) x, где x = 1 ¸ 4. По химическим свойствам различают следующие основания: – основные гидроксиды; общая формула Me(OH) n, где n = 1, 2. Например: Ca(OH)2, Fe(OH)2. Исключение составляют гидроксиды Zn(OH)2, Pb(OH)2, Sn(OH)2. Растворимые основания называются щелочи. Например: NaOH, KOH, Ba(OH)2; – амфотерные гидроксиды; общая формула Me(OH) n, где n = 3, 4. Например: Al(OH) 3, Fe(OH) 3, Ti(OH) 4.
|

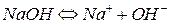 .
.


