Лабораторная работа № 6. Цель работы: исследование зависимости степени диссоциации от природы электролита, проведение реакций ионного обмена
РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ Цель работы: исследование зависимости степени диссоциации от природы электролита, проведение реакций ионного обмена, изучение влияния одноименных ионов на смещение равновесия. Электролитами называют вещества, расплавы или растворы которых проводят электрический ток. Электропроводность растворов обусловлена тем, что при растворении в воде или других полярных растворителях электролиты распадаются на положительно и отрицательно заряженные ионы (катионы и анионы), т. е. подвергаются электролитической диссоциации. К электролитам относятся кислоты, основания, соли. Процессы диссоциации описываются следующими уравнениями:
Электролитической диссоциации соответствует обратный процесс – образование молекул из ионов, называемый ассоциацией. Таким образом, в растворах электролитов устанавливается равновесие между молекулами и ионами. Константа равновесия для данного случая называется константой диссоциации. Например, константа диссоциации (КД) сернистой кислоты будет равна:
Для характеристики электролита удобно пользоваться понятием степень диссоциации: a = С 1 / С, где С 1 – число молекул, распавшихся на ионы, С – общее число молекул электролита в растворе. Степень диссоциации определяется экспериментально и выражается в долях единицы или в процентах. Зависит от следующих факторов: природы электролита, его концентрации, присутствия в растворе одноименных ионов, температуры раствора. Связь между константой диссоциации и концентрацией раствора для растворов электролитов, в которых a < < 1, выражается соотношением
Если a > 30 %, то электролит относится к сильным. Это все растворимые соли и основания (за исключением NH 4 OH) и минеральные кислоты HCl, HNO 3, H 2 SO 4, HClO 4 и другие. Для слабых электролитов a < 3 %. К ним относятся H 2 S, H 3 PO 4, H 2 CO 3, H 2 SO 3, HCN и др. Реакции в растворах электролитов являются необратимыми в том случае, когда при взаимодействии ионов образуются малорастворимые (осадки), малодиссоциирующие или газообразные вещества, комплексные соединения. Сущность таких реакций наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. В таких уравнениях слабые электролиты, малорастворимые и газообразные соединения записываются в молекулярной форме, сильные электролиты – в виде составляющих их ионов. Рассмотрим процесс, протекающий с образованием осадка: – молекулярное уравнение Fe 2(SO 4)3 + 6 NaOH = 2 Fe (OH)3¯ + 3 Na 2 SO 4; – полное ионно-молекулярное уравнение 2 Fe 3 + + 3 SO 42– + 6 Na+ + 6 OH– = 2 Fe (OH)3¯ + 6 Na+ + 3 SO 42 –; – краткое ионно-молекулярное уравнение: 2 Fe 3+ + 6 OH– = 2 Fe (OH)3¯. Растворимость осадков характеризуется произведением растворимости (ПР), которое равно произведению концентраций ионов электролита в насыщенном растворе и является постоянной при данной температуре величиной: ПР(Fe (OH)3) Чем меньше произведение растворимости, тем менее растворимо вещество. При введении одноименных ионов в раствор малорастворимого электролита растворимость его уменьшается. И наоборот, если связывать один из ионов малорастворимого электролита, то происходит растворение осадка. Экспериментальная часть Опыт 1. Сравнение электропроводности растворов (выполняется группой). Выполнение работы
Во время опыта следите за накалом лампочки, и сделайте качественный вывод о силе исследуемых кислот и оснований по степени ее накала. Запишите уравнения электролитической диссоциации, степени и константы диссоциации (табл. 10) исследуемых электролитов. Опыт 2. Зависимость степени диссоциации от природы растворителя (выполняется группой). Выполнение работы Опыт выполняется на той же установке. В стаканчик поместите на кончике шпателя хлорид кобальта и добавьте 20 мл ацетона. Опустите в стаканчик тщательно промытые угольные электроды отметьте накал лампы. Затем добавьте 10 мл дистиллированной воды. Что наблюдаете? Опишите результаты наблюдений и объясните их.
|

 = 1, 3 · 10-2;
= 1, 3 · 10-2; 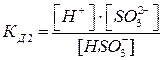 = 6, 3 · 10-8.
= 6, 3 · 10-8. .
.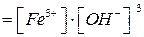 = 1, 8 · 10-38.
= 1, 8 · 10-38.
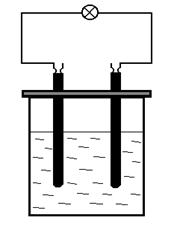 Пользуясь установкой, схема которой показана на рис. 2, сравните электропроводности растворов. Для этого в четыре стаканчика налейте по 20-30 мл 0, 1 н растворов: в первый – соляной кислоты, во второй – гидроксида натрия, в третий – уксусной кислоты, в четвертый – гидроксида аммония. Опустите в каждый из стаканчиков угольные электроды. Каждый раз перед опусканием электродов в раствор, их следует тщательно промывать дистиллированной водой.
Пользуясь установкой, схема которой показана на рис. 2, сравните электропроводности растворов. Для этого в четыре стаканчика налейте по 20-30 мл 0, 1 н растворов: в первый – соляной кислоты, во второй – гидроксида натрия, в третий – уксусной кислоты, в четвертый – гидроксида аммония. Опустите в каждый из стаканчиков угольные электроды. Каждый раз перед опусканием электродов в раствор, их следует тщательно промывать дистиллированной водой.


