Опыт 6. Влияние силы кислоты и основания на степень гидролиза
Выполнение работы В две пробирки налейте по 5-7 капель дистиллированной воды. В первую пробирку внесите несколько кристалликов сульфита натрия, во вторую – карбоната натрия. Перемешайте, добавьте в каждую пробирку по одной капле фенолфталеина, сравните окраску растворов. В какой из пробирок гидролиз прошел полнее? Ответ подтвердите расчетом величины константы гидролиза (по первой ступени). Контрольные вопросы 1. Что такое рН? Какова математическая зависимость между рН и концентрацией ионов водорода [ H+ ]? 2. Для одного раствора рН = 5, для другого рН = 2. Какой раствор более кислый? Во сколько раз в нем концентрация водородных ионов выше, чем в другом? 3. Какие реакции называются реакциями гидролиза? 4. Приведите примеры гидролиза соли, образованной а) слабым основанием и сильной кислотой, б) сильным основанием и слабой кислотой. 5. Какую соль следует добавить к раствору соли CuCl 2, чтобы произошла реакция совместного гидролиза? Напишите несколько реакций. 6. Напишите уравнения реакций гидролиза следующих солей:
Какое значение рН (< 7 >) будут иметь растворы этих солей? 7. Что называется степенью гидролиза? Как влияют на степень гидролиза температура, концентрация раствора, природа соли? 8. Константа диссоциации синильной кислоты (HCN) равна 7, 2 ×
|

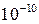 , а хлорноватистой (HClO) 3, 0× 10
, а хлорноватистой (HClO) 3, 0× 10 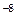 . Какая из солей – KCN или KClO будет подвергаться гидролизу в большей степени?
. Какая из солей – KCN или KClO будет подвергаться гидролизу в большей степени?


