Лабораторная работа № 10. Цель работы: Ознакомление с процессами, протекающими на растворимых и нерастворимых электродах при электролизе водных растворов солей
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ СОЛЕЙ Цель работы: Ознакомление с процессами, протекающими на растворимых и нерастворимых электродах при электролизе водных растворов солей. Электролизом называется совокупность процессов, протекающих при пропускании постоянного электрического тока через раствор или расплав электролита. Электролиз проводят в электролизерах, в которые помещают электролит и электроды. Электрод, на котором идет процесс восстановления (катод), подключают к отрицательному полюсу источника тока, электрод, на котором протекает процесс окисления (анод) – к положительному полюсу. Электроды при электролизе могут быть инертными (нерастворимыми), например, графит, платина, золото и др., и активными (растворимыми), если потенциал металла, из которого изготовлен электрод, меньше, чем потенциал других восстановителей в растворе. Рассмотрим электродные реакции на примере электролиза расплава хлорида кальция. В расплаве хлорида кальция имеются ионы а) восстановление ионов (катодный процесс) – б) окисление ионов
Суммарная реакция: В рассмотренном примере в электролите находились один вид катионов и один вид анионов, поэтому схема электролиза была простая. Однако часто в электролите присутствуют несколько видов катионов и анионов. Например, в водных растворах солей кроме катионов и анионов соли всегда имеются ионы Рассмотрим последовательность электродных процессов. На катоде в первую очередь будут восстанавливаться наиболее сильные окислители с большим положительным потенциалом. 1. Легко восстанавливаются катионы металлов, электродные потенциалы которых больше нуля: 2. Не восстанавливаются из водных растворов катионы металлов, потенциал которых меньше, чем (– 0, 8 В):
3. При большой плотности тока из водных растворов восстанавливаются катионы металлов с потенциалом от – 0, 8 до 0 В: На аноде в первую очередь будут окисляться наиболее сильные восстановители – вещества с наименьшим электродным потенциалом. 1. Легко окисляются анионы бескислородных кислот: I –; Br –; Cl –; S 2– и др. 2. Не окисляются в водных растворах ионы кислородосодержащих кислот:
3. В случае активного анода растворяется анод-металл: Электродные реакции окисления и восстановления, происходящие в двойном электрическом слое, называются первичными. Вторичные реакции обусловлены взаимодействием продуктов первичных реакций друг с другом, с материалом электродов, со средой и не локализуются в двойном электрическом слое. Они могут быть ионными, окислительно-восстановительными и т.д. Например, электролиз раствора нитрата калия будет происходить следующим образом:
Законы Фарадея. Между массой превращенного при электролизе вещества и количеством прошедшего через электролит количества электричества существует связь, которая находит отражение в двух законах Фарадея. 1-й закон Фарадея. Масса образующегося при электролизе вещества пропорциональна количеству электричества, прошедшего через электролит:
Для определения количества выделяющихся при электролизе газов удобнее пользоваться эквивалентными объемами:
2-й закон Фарадея. При пропускании равного количества электричества через растворы разных электролитов масса каждого из веществ, претерпевающих превращение, пропорциональна молярным массам эквивалентов этих веществ: m 1: m 2: m 3 = Мэ 1: Мэ 2: Мэ 3. (18) Для превращения одного моль-эквивалента вещества требуется одно и то же количество электричества, называемое постоянной Фарадея F (96485 Кл/моль-экв). Пользуясь математическим выражением 1-го закона Фарадея можно производить различные расчеты в электрохимии. В частности, на законах Фарадея основана кулонометрия – измерение количества электричества, прошедшего через цепь. Использование кулонометров дает возможность определить долю полезно затраченного тока, (т. е. тока, израсходованного на получение продукта), которая характеризуется выходом по току. Выход по току (h) – это отношение массы фактически полученного при электролизе вещества к теоретически рассчитанному
Экспериментальная часть
|

 и
и  . При пропускании тока через расплав начнется направленное движение ионов и на электродах будут протекать следующие реакции:
. При пропускании тока через расплав начнется направленное движение ионов и на электродах будут протекать следующие реакции: ;
; .
. .
. ,
,  и молекулы воды, способные к электрохимическому окислению и восстановлению.
и молекулы воды, способные к электрохимическому окислению и восстановлению. и др.
и др. и др., а восстанавливается вода или ионы водорода:
и др., а восстанавливается вода или ионы водорода: ,
,
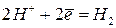 ,
,
 и др.
и др.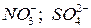 и др., а идет окисление гидроксогрупп или воды:
и др., а идет окисление гидроксогрупп или воды: ,
,
 ,
,
 .
.





 , (16)
, (16) ;
;
 , (17)
, (17)
 =11, 2 л/моль,
=11, 2 л/моль,
 = 5, 6 л/моль.
= 5, 6 л/моль.
 . (19)
. (19)


