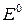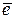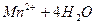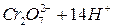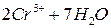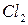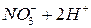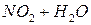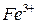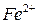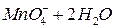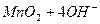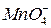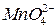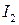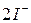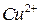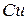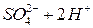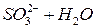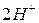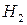Опыт 2. Окислительные свойства перманганата калия в различных средах
Выполнение работы В три пробирки внесите 3-4 капли раствора перманганата калия а) б) в) Контрольные вопросы 1. Дайте определение окислительно-восстановительных реакций. В чем их отличие от реакций обмена? 2. Что называется степенью окисления? У каких атомов в соединениях степень окисления постоянна? Определите степень окисления азота в соединениях: 3. Как количественно характеризуется окислительно-восстановительная способность веществ? По таблице 6 определите окислительно-восстановительные потенциалы переходов. К окислителям или восстановителям можно отнести эти вещества:
4. Окисление или восстановление происходит при переходах:
5. Как теоретически можно предсказать возможность протекания окислительно-восстановительной реакции? Какие из этих реакций возможны, а какие нет? Для возможных реакций составьте электронные схемы и расставьте коэффициенты: а) б) в) г) д) е) ж) з) и) к) л) м) н) о) п) р) с) 6. Назовите типичные окислители и восстановители. Стандартные окислительно-восстановительные потенциалы Таблица 6
|

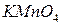 . В одну из них добавьте 2-3 капли 2 н раствора серной кислоты, в другую – столько же воды, в третью – 2 н раствора щелочи
. В одну из них добавьте 2-3 капли 2 н раствора серной кислоты, в другую – столько же воды, в третью – 2 н раствора щелочи  . Затем в каждую из пробирок внесите на кончике шпателя сухой сульфит натрия
. Затем в каждую из пробирок внесите на кончике шпателя сухой сульфит натрия 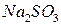 . Пробирки встряхните. Отметьте изменение окраски раствора в каждой пробирке. Для протекающих реакций составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель. Сделайте вывод о влиянии рН среды на окислительные свойства перманганата калия:
. Пробирки встряхните. Отметьте изменение окраски раствора в каждой пробирке. Для протекающих реакций составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель. Сделайте вывод о влиянии рН среды на окислительные свойства перманганата калия: ;
;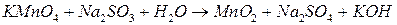 ;
; .
.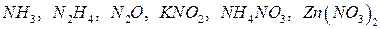 .
.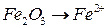 ;
;
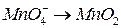 ;
;
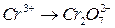 ;
;
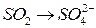 ;
;
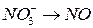 ;
;
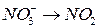 ?
?
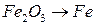 ;
;
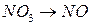 ;
;
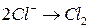 ;
;
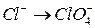 ;
;
 ;
;
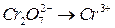 ?
?
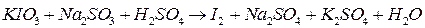 ;
;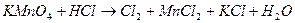 ;
;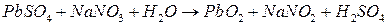 ;
; ;
;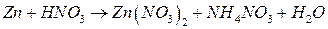 ;
; 
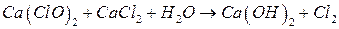 ;
;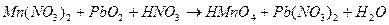 ;
;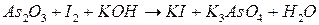 ;
;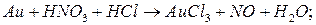
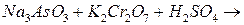

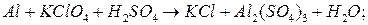
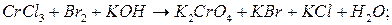
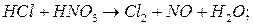
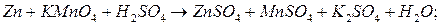
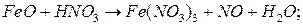
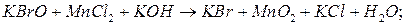
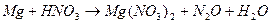 .
.