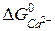Лабораторная работа № 9
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ Цель работы: измерить фактическую ЭДС гальванического элемента. Рассчитать ЭДС теоретическую и стандартную. Гальванические элементы – это химические источники тока, в которых энергия окислительно-восстановительных реакций непосредственно превращается в электрическую. Любой металл (проводник 1-го рода), погруженный в раствор электролита, называется электродом, а разность электростатических потенциалов, возникающая на границе между металлом и раствором, называется электродным потенциалом. Величина электродного потенциала зависит от химической активности металла, концентрации (активности) ионов металла в растворе, температуры, числа электронов и определяется уравнением Нернста:
Подставив в формулу(12) числовые значения R, T, F и, заменив натуральный логарифм десятичным, получим:
где Если два электрода, химическая активность металлов которых различна (например, цинк и медь), поместить в растворы собственных солей и соединить внешним проводником, то во внешней цепи можно зарегистрировать электрический ток (с помощью гальванометра). При этом металл с большей химической активностью (цинк) будет переходить в раствор, т. е. окисляться. Этот электрод называется анодом и имеет знак (–). Электроны накапливаются на аноде и заряжают его отрицательно. По внешнему проводнику электроны будут перемещаться к менее активному металлу (меди), и произойдет разряд ионов меди, т. е. восстановление. Этот электрод называется катодом и имеет знак (+). Суммарная окислительно-восстановительная реакция, протекающая на электродах, называется токообразующей. Гальванические элементы (ГЭ) – это системы, в которых электрический ток возникает за счет превращения энергии химических реакций в электрическую. ГЭ принято записывать в виде схемы. Например, схема медно-никелевого элемента записывается таким образом:
Электродные процессы:
ГЭ «работает» тем активнее, чем больше разность потенциалов электродов, его образующих. Работу ГЭ можно оценить величиной его электродвижущей силы (ЭДС) Е. Она равна разности потенциалов катода и анода:
Стандартную ЭДС гальванического элемента можно рассчитать, зная энергию Гиббса (
Например, рассчитаем ЭДС и стандартную ЭДС медно-никелевого элемента (3), если: концентрация
По формуле (2) рассчитаем электродный потенциал медного электрода:
= + 0, 34 – 0, 059 = 0, 281 В. Потенциал никелевого электрода равен его стандартному электродному потенциалу, так как концентрация
По формуле (14) ЭДС гальванического элемента будет: ЕТеор. = Еk – Еa = 0, 281 – (–0, 25) = 0, 53 В; теоретическая ЭДС по формуле (14) для токообразующей реакции будет: ЕТеор. = 0, 281 – (–0, 25) = 0, 53 В; стандартная ЭДС по формуле (15) для токообразующей реакции будет:
Для точного измерения ЭДС используют компенсационный метод. Прямое измерение приводит к определению напряжения, которое всегда меньше, чем ЭДС, из-за поляризации электродов и омических потерь. U = E – IR – DE,
Более простой, но менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента вольтметром, имеющим высокое омическое сопротивление. При этом мала сила тока, протекающая через элемент, поэтому невелика разница между ЭДС и напряжением элемента. Экспериментальная часть Выполнение работы: Соберите ГЭ из двух металлических электродов: первый – Cu / Zn, второй – Cd / Zn. Металлические стержни тщательно зачистите наждачной бумагой и опустите в стаканчики с растворами их солей. Места спая не должны касаться раствора. Соедините стаканчики жидкостным электролитическим мостиком (изогнутая стеклянная трубка, заполненная электролитом). Концентрации растворов: Подсоедините ГЭ к вольтметру и запишите показания прибора. Для всех исследуемых элементов: а) запишите схему ГЭ (3); б) запишите уравнения электродных процессов и токообразующей реакции; в) по уравнению Нернста рассчитайте величины равновесных потенциалов электродов (13); г) рассчитайте теоретическую ЭДС (14); д) по термодинамическим данным рассчитайте стандартную энергию Гиббса токообразующей реакции и стандартную ЭДС (15):
6. Полученные данные сведите в таблицу:
7. Сделайте вывод о проделанной работе. Контрольные вопросы 1. Дайте определение электродного потенциала и объясните механизм его возникновения на границе металл – раствор электролита. 2. От каких факторов зависит величина электродного потенциала? Запишите формулу Нернста и определите потенциалы медного, никелевого, серебряного, литиевого, магниевого электродов, погруженных в 0, 1; 0, 01 М растворы своих солей. 3. Дайте определение ГЭ и на примере объясните принцип его работы. 4. Как определяется анод и катод в ГЭ? Запишите электродные процессы для следующих гальванопар: Ag / Ni; Li / Cd; Cu / Mg; Zn / Ca; Cu / Hg; Ag / Ca. 5. Какие реакции называются токообразующими? Для указанных в п. 4 гальванопар запишите уравнения токообразующих реакций. 6. Как можно рассчитать ЭДС ГЭ теоретически? Рассчитайте стандартные ЭДС, используя: а) значения стандартных потенциалов; б) термодинамические функции ионов для следующих реакций:
7. Почему напряжение ГЭ всегда меньше ЭДС?
|

 , (12)
, (12)

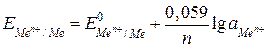 , (13)
, (13) – 0, 25 B;
– 0, 25 B; 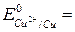 + 0, 34 B.
+ 0, 34 B.





 . (14
. (14 ) токообразующей реакции:
) токообразующей реакции: , (15)
, (15) – 0, 01 моль/л, а
– 0, 01 моль/л, а  – 1 моль/л;
– 1 моль/л;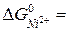 – 64, 4 кДж/моль,
– 64, 4 кДж/моль,  64, 98 кДж/моль.
64, 98 кДж/моль.
 –0, 25 В.
–0, 25 В.
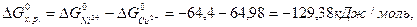

 – 1 моль/л;
– 1 моль/л;  – 0, 1 моль/л.
– 0, 1 моль/л. = 64, 98 кДж/моль;
= 64, 98 кДж/моль;  = –147, 21 кДж/моль;
= –147, 21 кДж/моль;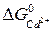 = –77, 74 кДж/моль.
= –77, 74 кДж/моль. ;
;
 ;
;
 ;
;
 ;
;