Опыт 4. Коррозия в результате неравномерного доступа кислорода
Выполнение работы Стальную пластинку тщательно очистите наждачной бумагой, промойте водой и высушите фильтровальной бумагой. На пластинку нанесите пипеткой каплю раствора электролита, который содержит хлорид натрия, гексацианоферрат (III) калия K 3[ Fe (CN)6] и фенолфталеин. K 3[ Fe (CN)6] – чувствительный реактив на ионы Fe 2 + , взаимодействие с которым дает синее окрашивание.
По краям капли атмосферный кислород проникает быстрее к поверхности пластины, чем в средней части. Участок поверхности металла с большей концентрацией окислителя будет катодом, а в средней части развивается анодная реакция окисления металла. Нарисуйте схему распределения окраски в капле, укажите анодный и катодный участки макрогальванического коррозионного элемента. Составьте уравнения реакций на аноде и катоде. Напишите уравнение реакции ионов Fe 2 + с гексацианоферратом (III) калия. Контрольные вопросы 1. Дайте определение процесса коррозии. Чем химическая коррозия отличается от электрохимической? Приведите примеры. 2. Каков механизм электрохимической коррозии? В чем отличие этой коррозии от процессов, протекающих в гальванических элементах? 3. Назовите причины энергетической неоднородности поверхности металлов и сплавов. 4. Напишите процессы, протекающие при электрохимической коррозии луженой меди, никелированного железа, Ca│ Zn - сплава в растворе а) серной кислоты, б) во влажном воздухе. 5. Каким образом можно теоретически предсказать невозможность коррозии металла? 6. Дайте определение скорости коррозии. От каких факторов она зависит? 7. Назовите активаторы коррозии. Объясните причину коррозионной активности ионов хлора. 8. Какую роль играют окислители, содержащиеся в коррозионной среде? Что называется пассивацией металла? Какие металлы склонны к пассивации?
|

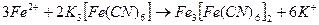
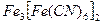 – турнбулева синь
– турнбулева синь


